Services on Demand
article
Indicators
Share
Revista de Etologia
Print version ISSN 1517-2805On-line version ISSN 2175-3636
Rev. etol. vol.8 no.1 São Paulo June 2006
ARTIGOS
Comparações entre os comportamentos de forrageio nas diferentes faixas etárias do boto-cinza (Sotalia guianensis) (Cetacea; delphinidae) na Baia dos Golfinhos, Praia de Pipa - RN - Brasil
Milena Santos Monteiro1; Antonio Souto1; Lídio França do Nascimento2
1 Departamento de Zoologia, Centro de Ciências Biológicas, Universidade Federal de Pernambuco
2 Departamento de Psicobiologia, Centro de Bio Ciências, Universidade Federal do Rio Grande do Norte
ABSTRACT
The term 'forage' refers to the group of behaviours performed by dolphins in an attempt to obtain prey items. This study aims to describe and compare forage behavioral patterns of the gray dolphin in different age ranges. The animals were monitored from an observation point on a cliff at the Pipa Ecological Sanctuary, RN, using the ad libitum method (Altmann, 1974). The age ranges were categorized in adult, juvenile and infants. The bay was divided in nine areas and the day in two parts: morning and afternoon. Twenty-one forage behaviours were described, including chase, catch with or without leaps, group strategies and prey cast. There were no significant differences between the strategies (with or without leaps) performed by the adults and the juveniles. Adult dolphins got involved in fishing activities more intensely and were more successful in capturing preys than juveniles, while infants did not participate actively in fishing.
Keywords: Feeding, Forage strategies, Prey capture, Age range, Sotalia guianensis.
RESUMO
O termo “forrageio” refere-se ao conjunto de comportamentos realizados pelos golfinhos para obtenção de suas presas.O trabalho objetivou descrever e comparar os padrões de comportamento de forrageio realizados por diferentes faixas etárias do boto cinza (Sotalia guianensis). As observações foram feitas de um Mirante no Santuário Ecológico de Pipa, RN. O método amostral utilizado foi ad libitum (Altmann, 1974). A faixa etária consistiu nas categorias adulto, juvenil e infante. A baía foi dividida em nove áreas e o período em manhã e tarde. Foram descritos vinte e um comportamentos de forrageio, compreendendo perseguições, botes com e sem salto, estratégias em grupo e arremessos de presa. Não houve diferenças significativas entre estratégias com e sem saltos realizadas por adultos e por juvenis. Golfinhos adultos apresentaram atividade de pesca mais intensa e obtiveram mais sucessos em suas investidas na captura de presas do que juvenis, enquanto filhotes não participaram ativamente da pesca.
Palavras-chave: Alimentação, Estratégias de Forrageio, Captura de presas, Faixa etária, Sotalia guianensis.
Introdução
A espécie Sotalia guianensis (van Bénéden, 1864) pertence à ordem Cetacea, à sub-ordem Odontoceti e é uma das menores espécies de delfinídeos existentes, tendo em média 1,7 metros e podendo atingir no máximo 2,2 metros de comprimento (Hetzel & Lodi, 1993; Silva & Best, 1996).
A espécie Sotalia guianensis (van Bénéden, 1864) distribui-se geograficamente desde o litoral norte de Honduras, no Caribe (15058’S; 85042’W; Silva & Best, 1996) até o Estado de Santa Catarina, no Brasil (27035’S; 48034’W; Simões-Lopes, 1988). Habita regiões costeiras, principalmente baías, regiões estuarinas, em canais entre baías e mar aberto, entradas de rios e em áreas próximas a manguezais (Favaro, 2004; Torres & Beasley, 2003).
A dieta do boto-cinza é composta em grande parte por peixes das famílias Sciaenidae, Haemulidae, Gerreidae, Mugilidae, Paralechtidae, Batrocoididae e Trichiuridae, sendo a maioria desses demersais e associados com fundos arenosos ou barrentos. Em menor proporção, o boto alimenta-se de cefalópodes (Lolligunla brevis – Loliginidae) e crustáceos das espécies Penaeus paulensis, Penaeus schmitii (Borobia & Barros, 1989; Santos, Rosso, Santos, Lucato & Bassoi, 2001; Di Beneditto & Ramos, 2004).
De uma maneira geral, os comportamentos estudados em Sotalia guianensis compreendem atividades aéreas (saltos, cambalhotas, porpoising, periscópios e batidas de partes do corpo na água), deslocamentos e atividades de forrageio (perseguição, bote, arremesso da presa e estratégias de forrageio individuais ou em grupo) (Andrade, siciliano & Capistrano,1987; Araújo, Passavante, Souto, 2001; Geise, 1991; Hayes, 1998; Nascimento, 2002; Poletto, 2003; Spinelli et al., 2002; Souza, 2004).
O termo “forrageio” tem sido utilizado para descrever um conjunto de atividades comportamentais realizadas por cada golfinho ou por um grupo de golfinhos para obtenção de suas presas (Hayes, 1998). Essas atividades consistem em deslocamentos na superfície da água seguidos de mergulhos para captura de presas, perseguições a presas, arremesso da presa, mergulho em áreas com possível abundância de alimento e consumação da presa (Araújo et al., 2001; Bel´Kovich, Ivanova, Yefremenkova, Kozarovitsky & Kharitonov 1991; Geise, 1991; Nascimento, 2002; Nowacek, 2002).
As primeiras descrições de estratégias alimentares do boto cinza se referem a dois tipos básicos de comportamentos: a Pesca ao acaso ou aleatória e a Pesca cooperativa ou comunitária (Andrade et al., 1987; Borobia, 1984; Flores, 1991; Geise, 1991; Monteiro-Filho, 1991). Rossi-Santos (1997) registrou a ocorrência de seis estratégias de pesca para o boto-cinza em Santa Catarina, as quais foram denominadas: Pesca aleatória individual, Pesca aleatória em grupo, Pesca cooperativa em leque, Pesca cooperativa circular, Pesca cooperativa cruzada e Pesca cooperativa em Zigue-Zague. Polleto (2003), em sua pesquisa realizada na Baía de Sepetiba, descreve as estratégias de alimentação individual, Fronte, Pesca oposta, Kettle e Costão rochoso, sendo as últimas quatro caracterizadas como estratégias em grupo.
O comportamento de forrageio, pode variar de acordo com vários fatores, tais como: espécie e tamanho do grupo de presas; seu habitat, comportamento e capacidade de fuga; estratégia utilizada pelo predador; experiência de vida adquirida; tamanho e interação do grupo de predadores. (Nascimento, 2002; Nowacek, 2002; Souto, 2003).
Embora alguns trabalhos sobre o comportamento do boto-cinza tenham sido realizados (e.g. Araújo et al., 2001; Geise, 1989, 1991; Hayes, 1998; Nascimento, 2002; Poletto, 2003; Spinelli et al., 2002; Simões-Lopes, 1997; Souza, 2004), pouco ainda se sabe sobre essa espécie, principalmente no que diz respeito ao comportamento de forrageio. O boto-cinza foi classificado como: espécie insuficientemente conhecida na Lista Vermelha de Animais Ameaçados da União Internacional para Conservação da Natureza e dos Recursos Naturais (IUCN, 2004); como espécie ameaçada de extinção no Apêndice I da Convenção sobre o Comércio Internacional das Espécies da Flora e da Fauna Selvagens em Perigo de Extinção (CITES, 2003); no Plano de Ação do Ibama para Mamíferos Aquáticos do Brasil (IBAMA, 2001); e espécie com estado de conservação desfavorável no Apêndice II da Convenção para Conservação de Espécies Migratórias de animais Selvagens (CMS, 2002).
Desta forma, o presente trabalho teve como objetivo descrever os comportamentos relacionados com a atividade de forrageio e estabelecer uma comparação entre as atividades de forrageio realizadas pelas diferentes faixas etárias, e o seu sucesso na captura de presas.
Material e Métodos
Área de estudo
A Baía dos Golfinhos localiza-se geograficamente em 6o12’ S e 35o04’ W e pertence ao Vilarejo de Pipa, situado no Município de Tibau do Sul, Rio Grande do Norte. A baía possui aproximadamente 720 metros de extensão, é contornada por falésias com cerca de 30 m de altura e apresenta um conjunto de rochas nas duas extremidades, formando uma baía semifechada. A região é influenciada pelo complexo estuarino da lagoa Guaraíras (Link, 2000). A topografia apresenta uma inclinação gradual em direção ao mar aberto e em uma das extremidades existe, um curral pesqueiro.
O clima do local é tropical com temperaturas geralmente entre 19oC e 28oC e pluviosidade média anual variando entre 1800mm até 3000mm (Carvalho, 2001), sendo a média mensal, durante os meses chuvosos (março a julho), de 324mm (Araújo et al., 2001). A umidade relativa anual média é de 76% e a salinidade varia entre 36 e 37‰ (Araújo et al., 2001). O ciclo da maré é semidiurno e durante o período de observação a maré atingiu os picos de 0.1 e 2.6 metros.
Procedimentos
As observações foram feitas de um ponto fixo, localizado em um mirante, de aproximadamente 20m de altura, no Santuário Ecológico de Pipa (6o13’36,7’’S; 35o03’36,7’’W). O mirante situava-se em local bastante favorável, uma vez que permitia uma visão panorâmica de toda a Baía dos Golfinhos e dos comportamentos realizados pelos botos-cinza. A distância máxima do mirante ao local onde se encontravam os animais, tida como “visualmente segura” foi de 200 metros, mas geralmente os golfinhos se posicionavam em pontos mais próximos do mirante.
O estudo foi conduzido durante 30 dias consecutivos nos meses de outubro e novembro de 2003 e durante 20 dias consecutivos nos meses de abril e maio de 2004, totalizando 222,3 horas de esforço amostral, das quais 164,6 horas os golfinhos estiveram presentes na Baía (esforço efetivo). O período de observação variou de quatro a nove horas diárias nos meses de outubro a novembro (62,3 horas) e foi utilizado na elaboração do método de coleta e de um etograma; enquanto nos meses de abril e maio o período foi de oito horas diárias (160 horas) sendo utilizado para coleta quantitativa dos dados.
Para facilitar a visualização dos animais e dos comportamentos, utilizou-se um binóculo 10x50 mm. O método amostral utilizado foi ad libitum (Altmann, 1974). As observações dos comportamentos, número e faixa etária dos botos presentes na Baía, hora e data da observação foram registradas em um gravador portátil Panasonic. Posteriormente, os dados foram passados para uma planilha pré-estabelecida e, finalmente, analisadas estatisticamente ou, no caso dos comportamentos, descritos e demonstrados na forma de desenhos.
A faixa etária do animal foi determinada utilizando o mesmo critério adotado por Geise et al. (1999), baseando-se na observação direta de animais em grupo, levando-se em consideração os tamanhos proporcionais do corpo dos golfinhos. Os animais imaturos apresentaram cerca de 3/4 do tamanho do animal adulto e os infantes cerca de 1/3 do tamanho do animal adulto. Os infantes puderam ser identificados também pela natação, na qual grande parte do corpo do animal ficava exposta no momento em que emergia para respirar, além de estarem sempre acompanhados com um animal adulto (Defran & Weller, 1999; Rossbach & Herzing, 1999).
Para padronizar o efeito da maior freqüência de adultos nos grupos observados na Baía dos golfinhos durante a pesquisa, foram efetuadas médias do número de comportamentos de forrageio realizados em cada faixa etária, pela quantidade de botos em atividade de pesca de cada faixa etária, pelo intervalo de tempo em que o grupo em observação permaneceu na Baía (minutos). Aos resultados aplicou-se o teste U de Mann-Whitney (não-paramétrico), adotando o índice de significância com p ≤ 0,05 (bilateral).
Resultados
Descrição dos Comportamentos
A segunda fase esteve relacionada à localização, perseguição e captura da presa pelos golfinhos. A localização da presa foi identificada por movimentos circulares na água, decorrentes da movimentação dos golfinhos. A perseguição foi determinada por deslocamentos realizados pelo boto na tentativa de capturar sua presa (Tab. I.a) (Fig. 1). O momento final da perseguição foi denominado de Bote e compreendeu um conjunto de condutas comportamentais realizadas pelo golfinho na tentativa de prender o peixe em sua boca (Tab. I.a; Fig. 2 e 3) e a Captura da presa propriamente dita, ocorreu no momento em que o golfinho foi observado com a presa em sua boca. Nessa fase, foram observadas também estratégias cooperativas realizadas por grupos de golfinhos (Tab. I.b; Fig. 4) e estratégias individuais sem nenhuma correlação aparente.

Tabela 1a. Etograma dos comportamentos de forrageio realizados pelo boto-cinza na baía dos Golfinhos.
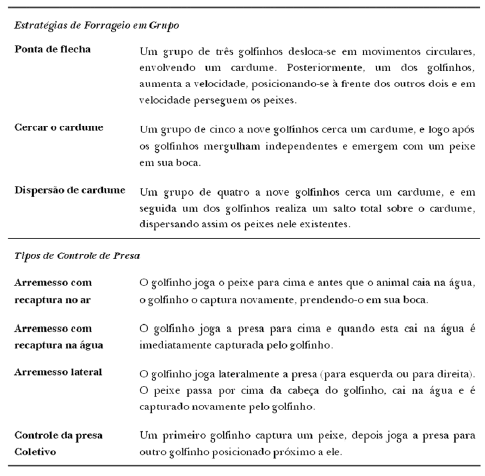
Tabela 1b. Etograma dos comportamentos de forrageio realizados pelo boto-cinza na baía dos Golfinhos.
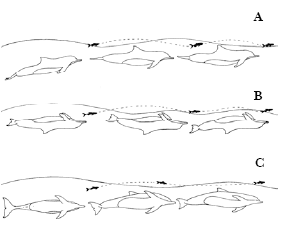
Figura 1. Tipos de perseguições. a) Perseguição de doso para cima; b) Perseguição de ventre para cima; c) perseguição lateral.
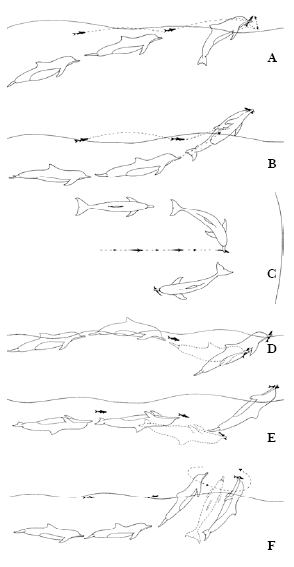
Figura 2. Tipos de Botes sem saltos. a) Bote Lateral; b) Bote de baixo para cima; c) Bote Meia lua; d) Bote com deslocamento lento; e) Bote com deslocamento; f) Bote com giro de 360º.
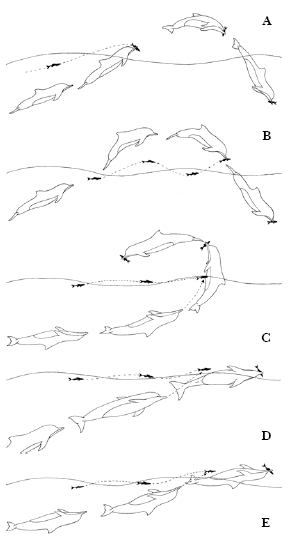
Figura 3. : Tipos de Botes com saltos. a) Bote de baixo para cima com salto; b) bote de cima para baixo com salto; c) Bote Adiantado; d) Bote com salto rasante parcial lateral; e) Bote com salto de ventre para cima.
A terceira fase constituiu a fase de controle da presa, caracterizada por vários movimentos de arremesso da presa ao ar (Tab I. b) (Fig. 4), e de ingestão da presa.
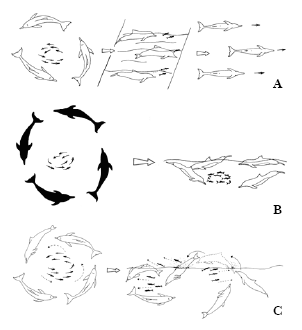
Figura 4. Tipos de estratégias em grupo. a) estratégia ponta de flecha; b) Pesca Cooperativa circular; c) estratégia de dispersão de cardume.
Freqüências de ocorrência dos tipos de botes utilizados na perseguição:
As estratégias de captura observadas em maior freqüência foram “Bote de baixo para cima sem salto” (20,61%), “Bote com salto rasante lateral parcial” (19,52%) e “Bote lateral” (19,14%), e os comportamentos observados em menores freqüências foram “Bote com giro de 360º” (0,7%) e “Bote Adiantado” (0,27%) (Fig. 5).
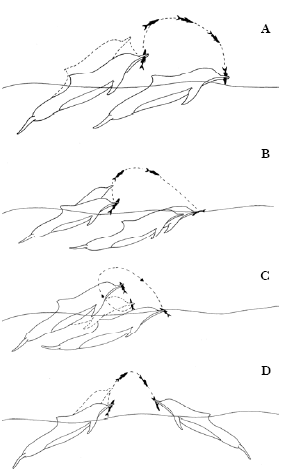
Figura 5. Tipos de controle de presa. a) arremesso com recaptura no ar; b) arremesso com recaptura na água; c) arremesso lateral; d) Transferência de Presa.
Variação do Comportamento de Forrageio de Acordo com a Faixa Etária:
Durante a realização da pesquisa, indivíduos adultos estiveram presentes 69,38% das observações, enquanto juvenis foram observados em 21,68% e infantes em 8,94%.
Os golfinhos infantes foram observados junto com adultos e juvenis em grupos durante atividades de forrageio, assim como acompanhando adultos e juvenis em perseguições não associadas com grupos. Porém, os infantes não completavam suas perseguições, interrompendo-as antes de chegarem à zona de arrebentação das ondas, enquanto os adultos e juvenis continuavam a perseguir suas presas. Durante o período de estudo nenhum peixe foi visto na boca de infantes. Sendo assim, nenhum sucesso foi constatado para os infantes. Por não apresentarem participação efetiva no comportamento de forrageio, os testes estatísticos foram apenas aplicados às comparações entre comportamentos de adultos e juvenis.
De acordo com os resultados obtidos, houve uma diferença significativa entre a freqüência de perseguições e sucessos obtidos na captura de presas entre adultos e juvenis, demonstrando que adultos perseguem mais presas (71,84%) e também obtêm maior sucesso (70,28%) durante suas perseguições do que juvenis. Porém não houve diferença significativa entre adultos e juvenis no que diz respeito à freqüência de controle de presas (Fig. 8).
A partir dos resultados foi possível inferir que não houve diferença significativa entre a freqüência observada de utilização de botes com saltos (37,5 %) e sem saltos (65,75 %) por adultos, e com salto (45,12 %) e sem salto (54,88 %) por juvenis (Fig. 9).
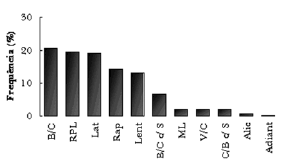
Figura 6. Freqüências observadas dos onze tipos de botes utilizados na perseguição pelo Sotalia guianensis para capturar presas na Baía dos Golfinhos - RN. B/C= Bote de baixo para cima; RPL= Bote rasante lateral parcial; Lat= Bote lateral; Rap= Bote com deslocamento rápido; Lent= Bote com deslocamento lento; B/C c/ S= Bote de baixo para cima com salto; ML= Bote Meia lua; V/C= Bote de ventre para cima; C/B c/ S= Bote de cima para baixo com salto; Alic= Bote alicate; 360º= Bote com giro de 360º.
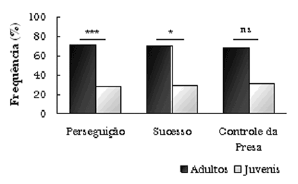
Figura 7. Percentagem de indivíduos nas diferentes faixas etárias presentes durante a observação de grupos de botos na Baía dos Golfinhos.
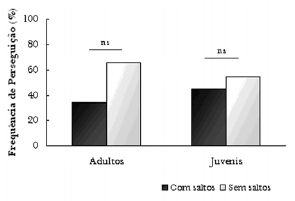
Figura 8. Comparação das freqüências dos comportamentos de perseguição, Sucesso na Perseguição e Controle da presa, utilizados entre as diferentes faixas etárias na Baía dos Golfinhos. Estatística: Teste U de Mann-Whitney; na = 17; nj = 17; Perseguições: U = 46,00; Z = -3,39; * p < 0,05. Sucessos: U = 82,00; Z = -2,15; *** p = 0,001. Controle da presa: U = 97,50; Z = -1,71; ns = não-significativo (bilateral).
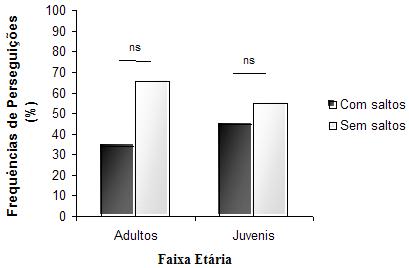
Figura 9. Comparação entre as freqüências de uso das perseguições com salto e sem salto em adultos e em juvenis. Estatística: Teste U de Mann-Whitney; n1 = 17; n2 = 17; Adultos: U = 96,00; Z = -1,67; ns = não-significativo; Juvenis: U = 124,50; Z = -0,709; ns = não-significativo (bilateral).
Discussão
Comportamentos de Forrageio
Perseguições
O comportamento de perseguição é usado por muitos pesquisadores para caracterizar o comportamento de caça (Araújo et al., 2001; Hayes, 1998; Nascimento, 2002; Souza, 2004). A posição corporal que o golfinho assume durante a perseguição talvez esteja relacionada com a posição em que se encontra em relação à presa, ou com o possível tipo de estratégia que será adotada pelos golfinhos para capturá-la. Esse posicionamento do golfinho pode ser usado para facilitar a localização da presa, seja utilizando o sistema de ecolocalização ou o visual.
Os tipos de perseguição com “Bote de baixo para cima”, “Rasante lateral parcial” e “Lateral” foram mais freqüentes, possivelmente por proporcionarem maior velocidade no momento da captura do peixe, uma vez que apresentam um deslocamento hidrodinâmico durante a perseguição e um bote que não provoca grandes perturbações na água (Burggren, Randal & French, 2000). Comportamentos semelhantes foram descritos para o golfinho nariz-de-garrafa (Tursiops truncatus) (Bel’Kovich et al., 1991).
Nas perseguições com “Deslocamento rápido” e com “Deslocamento lento”, os golfinhos permanecem alguns minutos se deslocando na baía e, na maioria do tempo, permanecem submersos logo abaixo da superfície da água. Isso pode indicar a utilização mais efetiva da ecolocalização durante a captura do peixe, podendo, talvez, ser favorecido devido aos botos-cinza possuírem um sistema de ecolocalização bastante aguçado (Monteiro-Filho & Monteiro, 2001; Norris & Dohl, 1980). Esses comportamentos podem representar também um tipo de forrageio oportunista, onde o golfinho detecta presas durante deslocamentos entre uma área e outra da baía (Nowacek, 2002).
Nas perseguições com “Bote de baixo para cima com salto”, de “Ventre para cima” e com “Bote de cima para baixo”, o animal necessita visualizar a presa fora da água para localizá-la no momento exato em que salta e a captura, o que pode exigir mais técnica e precisão do golfinho. Comportamentos semelhantes a esses também foram reportados para golfinhos nariz-de-garrafa (Bel’Kovich et al., 1991). O comportamento de “Meia lua” parece ser utilizado como uma forma de direcionar o peixe para a zona de arrebentação, onde o peixe pode ter sua agilidade diminuída, uma vez que o espaço de fuga para o peixe diminui, acarretando menor custo energético para o boto.
O fato de presas serem encontradas inteiras no conteúdo estomacal de golfinhos indica não haver mastigação antes da deglutição (Santos et al., 2001). Desta maneira, a perseguição com “Bote com giro de 360º” parece estar relacionada ao posicionamento do golfinho para facilitar a captura e ingestão da presa.
A perseguição com “Bote adiantado” apresentou freqüências baixas provavelmente por demonstrar um grau de dificuldade aparentemente maior do que os outros tipos de perseguição. Talvez, para obter sucesso, o golfinho necessite alcançar uma velocidade maior do que a do peixe, para obter espaço antes que a presa alcance a região mais rasa da zona de arrebentação. Desta forma, o golfinho precisaria de tempo para voltar, visualizar o peixe, saltar e capturar a presa enquanto esta permanece no ar. O fato de o golfinho se posicionar à frente do peixe pode demonstrar uma forma de conter o peixe antes que ele chegue nas áreas muito rasas.
É preciso salientar que essas estratégias foram observadas tanto ocorrendo de forma independente umas das outras como também em sucessão. Dessa forma, após uma tentativa de captura sem sucesso, o golfinho poderia utilizar outro tipo de perseguição ou dar continuidade ao mesmo comportamento.
Estratégia de Forrageio em Grupo
Na estratégia de “Pesca Cooperativa circular” (Rossi-Santos, 1997), utilizada por grupos de botos, esforços simultâneos de membros do grupo são alocados com a finalidade de manter a estrutura do cardume, de modo que, enquanto alguns animais localizados na periferia do cardume tentam manter o cardume coeso, outros golfinhos alimentam-se (Hayes, 1998; Monteiro-Filho, 1992; Rossi-Santos, 1997). Comportamentos que correspondem a este foram verificados em grupos de golfinhos-pintados-do-Atlântico (Stenella frontalis) (Fertl &Wursig, 1995), de orcas (Orcinus orca) (Nøttestad, Ferö & Axelsen, 2002), de golfinhos-nariz-de-garrafa (Wursig, 1979), de golfinhos-rotadores (Stenella logirostris) (Norris & Dohl, 1980) e de Boto-de-burmeister (Phocoena phocoena) (Bel’Kovich et al.,1991).
Na estratégia em grupo de “Dispersar cardumes”, os peixes são encurralados e empurrados para a superfície e, posteriormente, os golfinhos realizam saltos sobre o cardume. Nesse tipo de estratégia, parte do cardume é mantida unida por um grupo de golfinhos, enquanto a outra parte dos peixes é dispersada e perseguida por outros golfinhos (Fertl & Würsig, 1995; Geise, 1991; Monteiro-Neto, Alves-Júnior, Ávila, Oliveira & Furtado-Neto, 1996). A utilização de atividades aéreas em estratégias de forrageio como saltos, batida de partes do corpo do animal na água foram observadas para botos no Sul (Poletto, 2003) e Sudeste do país (Andrade et al., 1987; Rossi-Santos,1997).
A estratégia “Ponta-de-flexa” pode ser utilizada pelos golfinhos como uma maneira de direcionar o cardume para regiões mais rasas mantendo-o unido, com a finalidade de maximizar a captura. Comportamento este também descrito para golfinhos-naris-de-garrafa (Bel’Kovich et al. 1991). Rossi-Santos (1997) descreve um comportamento bastante parecido com o citado, o qual foi denominado “Pesca cooperativa em leque”, porém os golfinhos não se posicionam em formação de triângulo e sim paralelamente uns em relação aos outros.
O comportamento particular escolhido por um golfinho e o seu sucesso em uma determinada situação é provavelmente determinado por variáveis como espécie, comportamento e habitat da presa, bem como da especialização do próprio golfinho em determinada estratégia.
A plasticidade na ecologia individual de forrageio melhora a capacidade de adaptação a mudanças ambientais. Além disso, a alta especialização de estratégia alimentar reduz indiretamente a competição em caso de depleção de recursos (Norwacek, 2002).
Controle da Presa
O comportamento de “Arremesso com recaptura no ar” possivelmente está relacionado ao posicionamento adequado da presa a fim de evitar que as escamas e espinhos danifiquem o trato digestivo dos golfinhos, assim o boto ingere a presa pela cabeça. Por esse motivo o peixe é jogado algumas vezes para o ar e recapturado em seguida (Araújo et al., 2001; Bel’Kovich et al., 1991; Nascimento, 2002; Souza, 2004).
Nos comportamentos de “Arremesso com recaptura na água” e “Arremesso lateral” o peixe é jogado contra a água. Uma explicação possível para esses comportamentos seria a tentativa de desnortear ou até mesmo matar a presa com o impacto na água antes da sua consumação, ou ainda poderia indicar um comportamento de brincadeira em golfinhos imaturos (Araújo et al., 2001; Nascimento, 2002).
Em todas as vezes que o comportamento de “Transferência de Presa” (Spinelli et al., 2006) foi observado, o peixe foi abandonado morto na água após ser arremessado pelos golfinhos, permanecendo boiando sem ser recapturado. Esse comportamento poderia indicar um tipo de brincadeira ou, de reconhecimento de uma espécie que não faz parte da sua dieta. Porém estudos de reconhecimento da espécie do peixe abandonado precisam ser realizados para comprovar essa hipótese. Spinelli et al. (2006) observaram comportamentos de transferência de presas de adultos para infantes na Baía dos Golfinhos e sugeriram que esse comportamento de compartilhar alimento é utilizando como uma forma de aprendizado social. Entretanto não foi possível verificar as faixas etárias dos golfinhos durante esse comportamento.
Variação do Comportamento de Forrageio de Acordo com a Faixa Etária
O fato de golfinhos infantes não participarem ativamente de comportamentos de forrageio, provavelmente pode estar relacionado com a dependência alimentar materna. Porém, a presença desses animais durante as atividades de caça juntamente com adultos e juvenis pode indicar uma forma de aprendizado e treinamento de condutas que serão utilizadas nos próximos estágios de sua vida (Link, 2000; Lodi, 2003; Nowacek, 2002; Spinelli et al., 2002).
De acordo com os resultados obtidos, adultos apresentam atividade de caça mais intensa, o que pode ser explicado pelo fato de animais maiores apresentar taxas metabólicas maiores (Burggren, Randal & French, 2000). Além disso, adultos obtêm mais sucessos em suas investidas na captura de presas do que juvenis. Isso sugere que adultos teriam adquirido experiência ao longo de sua vida, o que os permitem maior facilidade para realizar atividades de pesca e precisão no momento da captura, enquanto juvenis encontram-se ainda em fase de aprendizado. Souza (2004) obteve resultados semelhantes em seu estudo com o boto-cinza em Baía Formosa - RN.
Tanto em adultos como em juvenis não houve diferença significativa entre a freqüência observada de perseguições utilizando botes com e sem saltos, o que talvez demonstre que a execução ou não de saltos pode estar associada à estratégia antipredador usada pelo peixe. Provavelmente o golfinho salte para capturar o peixe no ar, porque este não terá como mudar a rota a ser percorrida. Peixes como o agulha (Hemiramphus brasiliensis) adotam a estratégia de escapar das perseguições do predador saltando na superfície da água (Lewis & Schroeder, 2003).
A comparação da conduta “Controle da presa” não apresentou diferenças significativas entre adultos e juvenis, o que fortalece a hipótese desse comportamento ser utilizado para facilitar a ingestão de presas e não apenas como um comportamento de brincadeira.
Ao longo do estudo pôde-se constatar que a Baía dos Golfinhos representou um local bastante utilizado pelo boto-cinza para forrageio. A espécie apresentou um rico repertório comportamental, caracterizando-se por um conjunto de diversas condutas também utilizadas em outros padrões comportamentais, tais como deslocamentos e brincadeiras. Um outro ponto constatado foi que a atividade de forrageio variou em diferentes faixas etárias e, que possivelmente, os tipos de estratégias realizadas pelos botos-cinza estariam relacionadas a características peculiares de suas presas, como habitat, e às estratégias de fuga por elas adotadas.
Este trabalho constituiu um passo inicial para um melhor entendimento sobre os aspectos comportamentais e ecológicos do boto-cinza, porém faz-se necessária a realização de mais estudos sobre a ecologia alimentar dessa espécie, para esclarecer melhor a interação desses golfinhos com as espécies de peixes que compõem sua dieta.
References
Altmann, J. (1974). Observational study of behavior: Sampling methods. Behaviour, 49(3/4), 227-267. [ Links ]
Andrade, L., Siciliano, S., & Capistrano, L. (1987). Movimentos e atividades do boto Sotalia guianensis (Cetácea: Delphinidade) na Baía de Guanabara – Rio de Janeiro. (pp. 49-56). In Anais da II Reunião de Trabalho de Especialistas em Mamíferos Aquáticos da América do Sul. Rio de Janeiro.
Araújo, J. P., Passavante, J. Z. O., & Souto, A. S. (2001). Behavior the estuarine dolphin, Sotalia guianensis, at Dolphin Bay – Pipa – Rio Grande do Norte – Brazil. Tropical Oceanography, 29(2), 13-23.
Bel’Kovich, V. M., Ivanova, E. E., Yefremenkova, O. V., Kozarovitsky, L. B., & Kharitonov, S. P. (1991). Searching, behavior in bottlenose dolphin (Tursiops truncatus) in the Black Sea. In K. Prior & K. S. Norris (Eds.), Dolphin societs: Discoveries and puzzles (pp. 38-67). Berkeley, CA: University of California Press.
Borobia, M., & Barros, N. B. (1989). Notes on the diet of marine Sotalia fluviatilis. Marine Mammal Science, 5(4), 395-399. [ Links ]
Burggren, W., Randal, D., & French, K. (2000). Fisiologia animal. Rio de Janeiro: Guanabara Koogan. [ Links ] CITES. (2003). Convetion on trade in endagered species of wild fauna and flora - Appendix I. Reuperado em: 15 de out. de 2005: http://www.wcmc.org.uk/CITES/english/index.shtml [ Links ]
Convention on Migratory Species (CMS). (2002). Appendix II of convention on the conservation of migratory species of wild animals. Recuperado em: 15 out. de 2005: http://www.cms.int/documents/ appendix/cms_apphtm [ Links ]
Di Beneditto, A. P. M., & Ramos, R. M. A. (2004). Biology of the marine tucuxi dolphin (Sotalia fluviatilis) in south-eastern Brazil. Journal of Marine Biological Association of the United Kingdom, 84, 1245-1250 [ Links ]
Defran, R. H., & Weller, D. W. (1999). Occurrence, distribuition, site fidelity and school size of bottlenose dolphins (Tursiops truncatus) off San Diego, California. Marine Mammal Science, 15(2), 366-380. [ Links ]
Fertl, D., & Wüsig, B. (1995) Coordinated feeding by Atlantic spotted dolphins (Stenella frontalis) in the Golfo of Mexico. Aquatic Mammals, 21(1), 3-5. [ Links ]
Flores, P. A. C. (1992) Observações sobre o comportamento, movimentos e conservação do golfinho ou boto Sotalia fluviatilis (Gervais, 1953) (Mammalia, Cetácea, Delphinidae) na Baía Norte de Santa Catarina, SC, Brasil. Monografia de Bacharelado, Universidade Federal de Santa Catarina, Florianópolis. [ Links ]
Geise, L. (1989). Estrutura social, comportamental e populacional de Sotalia sp. (Gray, 1886) (Cetacea, Delphinidae) na região estuarino-lagunar de Cananéia, SP e na Baía de Guanabara, RJ. Dissertação de Mestrado, Universidade de São Paulo, São Paulo. [ Links ] Geise, L. (1991). O comportamento dos golfinhos. Ciência Hoje, 13(77), 27-33. [ Links ]
Geise, L., Gomes, N., & Cerqueira, R. 1999. Behavior, habitat use and population size of Sotalia fluviatilis (Gervais, 1853) (Cetacea: Delphinidae) in the Cananéia estuary region, São Paulo, Brazil. Revista Brasileira de Biologia, 59(2), 183-194. [ Links ]
Hayes, A. J. S. (1998). Aspectos da atividade comportamental diurna da forma marinha do tucuxi Sotalia fluviatilis Gervais, 1853 (Cetacea- Delphinidae), na Praia de Iracema (Fortaleza - Ceará - Brasil). Relatório de Licenciatura, Universidade do Algarve, Faro. [ Links ]
Hetzel, B., & Lodi, L. (1993). Baleias, botos e golfinhos: guia de identificação para o Brasil. Rio Janeiro: Nova Fronteira. [ Links ]
Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA). (2001). Plano de ação – Mamíferos Aquáticos do Brasil (Versão II). Brasília: DF.
IUNC (2004). Red list of Threatened Species. Gland, Switzerland. Recuperado em 15 de out. de 2005: www.redlist.org [ Links ]
Lewis, J., & Schroeder, W. (2003). Mud plume feeding, a unique forangig behavior of the Blottenose Dolphin in the Florida keys. Gulf Mexico Science, 21(1), 92-97. [ Links ]
Link, L. O. (2000). Ocorrência, uso do habitat e fidelidade ao local do boto-cinza, Sotalia fluvitilis, Gervais, 1853 (Mammalia: Cetácea), no litoral sul do Rio Grande do Norte. Dissertação de Mestrado, Universidade Federal do Rio Grande do Norte, Natal. [ Links ]
Lodi, L. 2003. Tamanho e composição de grupos dos botos-cinza Sotalia guianensis (Van Bénéden, 1864) (Cetácea, Delphinidae), na Baía de Paraty, RJ, Brasil. Atlântica, 25(2), 135-146. [ Links ]
Monteiro-Filho, E. L. A. (1991). Comportamento de caça e repertório sonoro do golfinho Sotalia brasiliensis (Cetácea: Delphinidae) na região da Cananéia, Estado de São Paulo. Tese de Doutorado, Universidade de Campinas, Campinas, SP. [ Links ]
Monteiro-Filho, E. L. 1992. A. Pesca associada entre golfinhos e aves marinhas. Revista Brasileira de Zoologia, 9(1/2), 29-37. [ Links ]
Monteiro-Filho, E. L. A., & Monteiro, K. D. K. A. (2001). Lown-frequency sound by Sotalia fluviatilis guianensis (Cetacea: Delphinidae) in an estuarine region in southeastern Brazil. Canadian Journal of Zoology, 79(1), 59-66. [ Links ]
Monteiro-Neto, C., T., Alves-Júnior, T. F., Ávila, J. C., Oliveira, J. A., & Furtado-Neto, M. A. A. 1996) Registros de cetáceos para o litoral do Estado do Ceará, Brasil. Arquivos Ciências do Mar, 30(1-2), 79-92. [ Links ]
Nascimento, L. F. (2002). Descrição comportamental do boto cinza (Sotalia fluviatilis, GERVAIS, 1853) no litoral sul do estado do Rio Grande do Norte. Dissertação de Mestrado, Universidade Federal do Rio Grande do Norte, Natal. [ Links ]
Norris, K. S., & Dohl, T. P. (1980). Behavior of the Hawaiian spinner dolphin Stenella longirostris. Fishery Bulletin, 77, 821-849. [ Links ]
Nottestad, L., Ferno, A., & Axelsen, B. E. (2002). Digging in the deep: Whales advanced hunting tactic. Polar Biology, 25, 939-941. [ Links ]
Nowacek, D. P. (2002). Sequential foraging behaviour of bottlenose dolphins, Tursiops truncatus, in Sarasota Bay, FL. Behaviour, 139(9), 1125-1145. [ Links ]
Pinedo, M. C., Rosas, F. C. W., & Marmontel, M. (1992). Cetáceos e pinípedes do Brasil: uma revisão dos registros e guia para identificação das espécies. Manaus, UNEP/FUA. [ Links ]
Poletto, F. R. (2003). Aspectos comportamentais da população de botos-cinza (Sotalia fluviatilis) na Baía de Sepetiba (RJ). Dissertação de Mestrado, Universidade Federal do Rio de Janeiro, Rio de Janeiro. [ Links ]
Rossbach, K. A., & Herzing, D. L. (1999). Inshore and offshore bottlenose dolphins (Tursiops truncatus) communities distinguished by association patterns near Grand Bahamas Island, Bahamas. Canadian Journal of Zoology, 77(4), 581-592 [ Links ]Santos, M. C. de O., Rosso, S., Santos, R. A., Lucato,
S. H. B., & Bassoi, M. (2002). Insights on small cetacean feeding habits in southeastern Brazil. Aquatic Mammals, 28, 38-45. Silva, da V. M. F., & Best, R. C. (1996). Sotalia fluviatilis. Mammalian Species. American Society of Mammalogists, 527, 1-17. [ Links ]
Simões-Lopes, P. C. (1988). Ocorrência de uma população de Sotalia fluviatilis Cervais, 1853, (CETACEAE, DELPHINIDAE) no limite Sul da sua distribuição, Santa Catarina, Brasil. Biotemas, 1(1), 57-62. [ Links ]
Souza, L. C. (2004). Quantificação e descrição de condutas comportamentais de infantes e adultos do boto Sotalia guianensis na praia de baía Formosa (Rio Grande do Norte, Brasil). Monografia de Conclusão do Curso de Ciências Biológicas Bacharelado, Universidade Federal de Pernambuco, Recife. [ Links ]
Souto, A. (2003). Etologia: princípios e reflexões. Recife: Editora Universitária UFPE. [ Links ]
Spinelli, L. H. P., Nascimento, L. F., & Yamamoto, M. E. (2002). Interações entre adultos e filhotes em grupos do boto cinza Sotalia fluviatilis na Praia de Pipa – RN. Estudos de Psicologia, 7(1), 165-171.
Torres, D., & Beasley, C. R. (2003). Pattern of use of a small bay in northern Brazil by Sotalia fluviatilis (Cetacea: Delphinidae). Amazoniana, 18 (3/4), 583-594. [ Links ] Wursig, B. (1979). Dolphins. Scientific American 240(3), 108-119. [ Links ]
 Endereço para correspondência
Endereço para correspondência
Milena Santos Monteiro
Departamento de Zoologia
Centro de Ciências Biológicas
Universidade Federal de Pernambuco
Avenida Arquitetura, s/n.
Campus Universitário, Cidade Universitária
50730-540 Recife – PE – Brasil
E-mail: golfomila@yahoo.com.br
Antonio Souto
Departamento de Zoologia, Centro de Ciências Biológicas,
Universidade Federal de Pernambuco,
Avenida Arquitetura, s/n.
Campus Universitário, Cidade Universitária,
Recife – PE – Brasil, 50730-540.
E-mail: asouto@elogica.com.br
Lídio França Do Nascimento
Departamento de Psicobiologia, Centro de Bio Ciências,
Universidade Federal do Rio Grande do Norte,
Campus Universitário - Natal – RN – Brasil.
Caixa Postal 1511 CEP: 59078-970.
E-mail: tkdelphinus@yahoo.com.br
Received April 07, 2006
Revision received August 28, 2006
Accepted September 11, 2006