Serviços Personalizados
Journal
artigo
Indicadores
Compartilhar
Cadernos de Pós-Graduação em Distúrbios do Desenvolvimento
versão impressa ISSN 1519-0307versão On-line ISSN 1809-4139
Cad. Pós-Grad. Distúrb. Desenvolv. vol.16 no.1 São Paulo jun. 2016
ARTIGO
Os polimorfismos do gene D2 e suas implicações em distúrbios cognitivos e comportamentais
Type 2 deiodinase polymorphisms and its implications in cognitive and behavioral disorders
Los polimorfismos del gen D2 y sus implicaciones en los trastornos cognitivos y de comportamiento
Alice BatistuzzoI; Miriam Oliveira RibeiroI
I Universidade Presbiteriana Mackenzie
Resumo
Hormônios tireoidianos são essenciais para o desenvolvimento e manutenção de órgãos. A enzima desiodase tipo 2 é a principal responsável pela disponibilização do hormônio ativo (T3) para os tecidos. Diversos polimorfismos identificados no gene desta enzima – DIO2 – correlacionam-se positivamente com distúrbios no comportamento, mas não é claro como a presença dos polimorfismos leva à essas condições. Sabe-se que diversos fatores podem contribuir para o agravamento ou facilitar o aparecimento de processos demenciais, déficits cognitivos e distúrbios neuropsicológicos. Apesar dos diversos estudos publicados sugerirem fortemente a existência de correlações entre os polimorfismos do DIO2 e os transtornos do comportamento, os mecanismos envolvidos ainda não foram identificados. A presente revisão pretende preencher essa lacuna, organizando as hipóteses de pôr quais vias se dão essas associações. Sugere-se que estresse oxidativo, estresses no Complexo de Golgi, redução na expressão do conjunto de genes envolvidos na via de sinalização do Receptor do Fator de Crescimento Epitelial (EGFR), na via de metabolismo do peptídeo beta-amilóide e alteração da atividade catalítica da D2 podem contribuir para o desenvolvimento ou ainda como agravantes dessas condições.
Palavras-chave: polimorfismo, desiodase tipo 2, comportamento, cognição.
Abstract
Thyroid hormones are essential for the development and maintenance of organs and tissues. The type 2 deiodinase enzyme is primarily responsible for the provision of the active hormone (T3) to the tissues. Several polymorphisms in your gene - DIO2 - have been positively correlated to behavioral disorders, but it´s not clear how they leads to these conditions. It is known that several factors may contribute to the worsening or facilitate the emergence of dementia processes, cognitive deficits and neuropsychological disorders. Despite many published studies strongly suggest the existence of correlations between polymorphisms DIO2 and behavioral disorders, the mechanisms involved have not been fully identified. This review intends to fill this gap and hypothesis were suggested on how these associations may occuer. It is suggested that oxidative stress, stress in the Golgi Apparatus, reduction in expression of the set of genes involved in the signaling pathway Epithelial Growth Factor Receptor (EGFR) and in the pathway of the metabolism of beta-amyloid peptide and alteration of the catalytic activity of D2 with consequent changes in serum levels of T3 and T4 may contribute to the development or as aggravating of these conditions.
Keywords: polymorphism, deiodinase type 2, behavior, cognition.
Resumen
Las hormonas tiroideas son esenciales para el desarrollo y mantenimiento de los órganos y tejidos. La enzima deiodinasa tipo 2 es la principal responsable de proporcionar la hormona activa (T3) para los tejidos. Diversos polimorfismos en su gen - DIO2 - correlacionan positivamente con alteraciones en el comportamiento, pero no está claro cómo la presencia de polimorfismos conduce a estas condiciones. Se sabe que varios factores pueden contribuir al empeoramiento o facilitar la aparición de procesos de demencia, déficit cognitivos y trastornos neuropsicológicos. A pesar de los numerosos estudios publicados sugieren fuertemente la existencia de correlaciones entre DIO2 polimorfismos y trastornos de conducta, no se han identificado los mecanismos implicados. Esta revisión tiene como objetivo llenar esta brecha y fueran criadas hipótesis acerca de las vias por las cuales suceden estas asociaciones. Se sugiere que el estrés oxidativo, estrés en el Complejo de Golgi, reducción en la expresión del conjunto de genes involucrados en la vía de señalización del Receptor del Factor de Crecimiento Epidérmico (EGFR) y en la vía del metabolismo del peptídeo beta-amilóide y alteración de la actividad catalítica de la D2 con la consiguiente alteración de los niveles séricos de T3 y T4 pueden contribuir para el desarrollo o empeoramiento de estas enfermedades.
Palabras clave: polimorfismo, tipo 2 deiodinasa, comportamiento, cognición.
Introdução
Os hormônios tireoidianos (HT) são essenciais para o desenvolvimento, crescimento e metabolismo de todos os vertebrados e seu aporte adequado é fundamental para o crescimento, diferenciação, regulação da atividade e metabolismo de órgãos e tecidos inclusive na vida adulta. Sua forma ativa, T3, é disponibilizada aos tecidos principalmente através da ação da enzima desiodase tipo 2 (D2).
Diversos polimorfismos funcionais no seu gene codificador – DIO2 – já foram descritos e alguns deles apresentam correlação com déficit cognitivo e distúrbios neuropsicológicos, como esquizofrenia, depressão e bipolaridade bem como com déficit cognitivo e demência. No entanto, o envolvimento do polimorfismo nessas patologias ainda não foi desvendado. A presente revisão pretende levantar hipóteses a respeito de como se dá a interferência dos citados polimorfismos do DIO2 em transtornos afetivos, demência e déficit cognitivo a partir de uma revisão crítica sobre os artigos já publicados.
Método
O processo de revisão se deu no período entre novembro de 2015 e fevereiro de 2016. Foram utilizadas as bases de dados Pubmed, Lilacs, Scopus, Bireme e Portal Periódico Capes sem limite de ano para data de publicação. A busca bibliográfica foi feita utilizando termos em português e inglês, sendo eles: polimorfismo (polymorphism), desiodase tipo 2 (deiodinase type 2), cognição (cognition) e comportamento (behaviour).
Discussão
Hormônios tireoidianos e desiodase tipo II
Durante o desenvolvimento fetal, a deficiência de HT pode levar a danos cerebrais irreversíveis (MORREALE DE ESCOBAR et al., 2004), como imaturidade do tecido, hipoplasia dos neurônios corticais, atraso na mielinização, desorganização durante a migração neuronal e redução da vascularização (BERBEL, 2001).
Em recém-nascidos, os sinais clínicos mais precoces do hipotiroidismo são icterícia prolongada, atraso na queda do funículo umbilical, hérnia umbilical e choro rouco. Ao longo dos meses podem apresentar dificuldade em se alimentar, baixo peso, congestão nasal, distúrbios respiratórios, obstipação, letargia, pela seca, fria e pálida, atraso no desenvolvimento neuropsicomotor, cognitivo e crescimento (SETIAN, 2007).
Quando o hipotiroidismo é adquirido somente após o nascimento, apesar do déficit cognitivo poder ser menos evidente, ainda haverá comprometimento no crescimento, maturação óssea e atraso na idade óssea. Quando adquirido na adolescência, o quadro clínico pode se apresentar como fadiga, obstipação intestinal, queda de cabelos, falta de apetite, unhas quebradiças, intolerância ao frio e dificuldades escolares. Em meninas pode ocorrer irregularidades na menstruação com aumento de fluxo (SETIAN, 2007).
Em indivíduos adultos disfunções tireoidianas levam a diversas alterações clínicas e que variam enormemente em função da gravidade, idade do indivíduo e da condição. O hipotireoidismo pode causar mixedema, dores de cabeça, parestesia, síndrome do túnel carpado, ataxia cerebelar, surdez, vertigem, frouxidão ligamentar, apnéia noturna, letargia, hiporreflexia, dificuldade com a coordenação motora, desatenção e falta de memória, sendo que também está associado ao transtorno bipolar afetivo, depressão e perda de funções cognitivas (WIERSINGA, 2013; BERNAL, 2015). Já o hipertireoidismo pode causar ansiedade, hiperreflexia e irritabilidade (GANGULI et al., 1996) e tanto hipotireoidismo quanto hipertireoidismo podem levar a demência, confusão mental, mudanças de personalidade e desordens de humor (BERNAL, 2015). De fato, já foram descritas associações entre hipotireoidismo, insanidade, psicose e Transtorno Afetivo Sazonal (BAHLS & DE CARVALHO, 2004; PAPI et al., 2007; ABREU, 2011) e altos níveis de T3 foram encontrados em pacientes com esquizofrenia (TURIANITSA et al., 1991).
A tireoide é a glândula responsável pela secreção dos hormônios tireoidianos (HT) tiroxina (T4) e de sua forma ativa, a triiodotironina (T3).
Todos os tecidos expressam receptores de HT e dele dependem para manter suas atividades, sendo importante garantir níveis intracelulares adequados de T3. Para tal, conta-se com duas vias: através da atividade tireoidiana regulada pelo sistema hipotálamo-hipófise-tireoide e pela geração periférica a partir do T4 que depende da ação de enzimas específicas, as iodotironinas desiodases (NUNES, 2005; NAIR, 2012). Cerca de 80% do T3 circulante é gerado a partir da desiodação do T4 (RODRIGUES et al., 2003; BIANCO, 2006).
Foram caracterizadas três isoformas: D1, D2 e D3. A desiodase tipo I (D1) é expressa predominantemente no fígado, rins, hipófise e tireoide (MEYER et al., 2007; NAIR, 2012) e pode tanto ativar T4 a T3 quanto desativar o T4 a T3 reverso (rT3) (BIANCO, 2006). A desiodase tipo 3 (D3) é a principal responsável pela degradação do HT, limitando sua ação biológica. Catalisa apenas o anel tirosínico do T4 e T3, gerando rT3 e T2 respectivamente. Nos indivíduos adultos, é encontrada principalmente no SNC e na pele, tendo sua ação aumentada no hipertireoidismo. No entanto, sua maior expressão se dá em tecidos fetais, placenta, útero gravídico e vasos umbilicais, garantindo que o feto não seja demasiadamente exposto ao HT ativo (WAGNER, 2001; MEYER et al., 2007).
A desiodase tipo 2 (D2) é altamente expressa no sistema nervoso central (SNC), hipófise, tecido adiposo marrom e placenta e disponibiliza T3 para o próprio tecido onde é encontrada, permitindo sua pronta utilização. Catalisa exclusivamente o anel fenólico do T4 e sua atividade é responsável por 50% da produção de T3 no córtex de seres humanos (CROTEAL et al., 1996; BIANCO, 2006). Sua regulação se dá por ubiquitinação que a inativa e pode ser degradada em grandes complexos de proteases conhecidos como proteossomas. No entanto, pode ser reativada através da interação da proteína von Hippel-Lindau com as enzimas de desubiquitinação 1 e 2, VDU1 e VDU2, respectivamente. Sua atividade é aumentada no hipotireoidismo, ou seja, quando a concentração de T4 cai, ativa-se a D2, compensando a redução do substrato através do aumento da proporção relativa de T4 para T3 convertido (BIANCO, 2006).
O gene responsável pela codificação da D2, identificado por DIO2, encontra-se no cromossomo 14, posição 14q.24.2-q.23 (CELI, 2000).
Até o presente momento, são bem descritos na literatura dois polimorfismos de único nucleotídeo (SNPs) funcionais desses genes, o Thr92-Ala e o ORFa-Gly3Asp. O Thr92-Ala é associado com diabetes mellitus, risco aumentado para Doença de Graves, hipertensão arterial, osteoartrite, aumento da remodelação óssea e recuperação de lesões pulmonares. O polimorfismo ORFa-Gly3Asp também é associado a osteoartrite e alterações nos níveis séricos dos hormônios tireoidianos, sendo que para ambos polimorfismos são descritas relações com distúrbios de comportamento, humor e cognição (VERLOOP, 2014; MCANINCH & BIANCO, 2015).
Além desses polimorfismos, foram publicados apenas dois artigos citando outros SNPs. Ambos relacionam a presença dos polimorfismos rs225010, rs225012, rs2267872 e rs1388378 com deficiência cognitiva em uma população específica da região de Qin-Ba, uma área no noroeste da China reconhecida por ser deficiente em iodo (GUO, 2004; ZHANG, 2012).
Os polimorfismos rs225010 e rs225012 localizam-se no intron 2 do DIO2 (GUO,2004; BUROKER, 2014). No caso do alelo DIO2-G do rs225012, ocorre a criação de quatro sítios de ligação exclusivos para os fatores de transcrição E2F6, ELF1, EGR1 e SPI1. Esses fatores de transcrição estão envolvidos no controle do ciclo celular, na ação de proteínas supressoras de tumor, na regulação da transcrição das células mielóides e na expressão gênica durante o desenvolvimento de células B-linfóide. Já no caso do alelo DIO2-A do rs225012, há criação dois sítios de ligação para os fatores de transcrição HOXA5 e NKX3-2 TFs, envolvidos no desenvolvimento do sistema regulatório e na regulação negativa, respectivamente (BUROKER, 2014).
No entanto, faltam informações mais detalhada na literatura sobre a estrutura desses SNPs bem como suas implicações na disponibilidade de HT e no funcionamento celular.
Polimorfismo Thr92Ala-D2
Em 2002, MENTUCCIA et al. descreveram o polimorfismo Thr92Ala-D2, identificado por rs225014, localizado no éxon 2 do DIO2 (NCBI, 2015). Nesse polimorfismo, ocorre a troca de um aminoácido treonina por uma alanina na posição 92. O nucleotídeo selvagem é Timina e o mutante é Citosina, o que leva a mudança de Adenina para Guanina, mudando os códons de ACA para GCA. Dessa forma o aminoácido muda de Treonina para Alanina, como visto na figura 1 (MENTUCCIA et al., 2002).
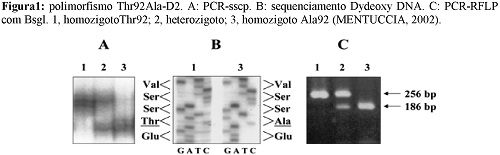
DORA et al (2010) mostraram uma prevalência 16,4% de homozigose desse SNP e 47,6% de heterozigose em uma amostra de 1057 indivíduos com diabete melittus tipo 2. APPELHOF et al. (2005) encontrou uma frequência de 40,4% do polimorfismo em 141 pacientes com hipotiroidismo primário e PEETERS et al. (2003) encontrou uma frequência de 38,8% de polimorfismo em uma população de 158 doadores de sangue saudáveis.
Esse polimorfismo causa aumento na meia-vida da D2, pois a alça de 18 aminoácidos que contém a mutação é responsável pela regulação da sua ubiquitinação, prejudicando sua degradação, mas sem alterar a sua atividade catalítica (MCANINCH et al., 2015).
ZEVENBERGEN et al. (2014) conduziram um estudo com o objetivo de identificar mutações na D2 e suas consequências funcionais em 387 pacientes com déficit intelectual não especificado. A análise sequencial da região codificadora do DIO2 revelou 2 mutações heterozigotas em 4 pacientes, uma mutação missense, ou seja, com a codificação de um aminoácido diferente do normal, idêntica em 3 pacientes (substituição na posição 4 do aminoácido Leucina por Histidina) e outra mutação missense (Treonina para Isoleucina na posição 102). Foi detectado o SNP Thr92Ala em 215 de 355 pacientes (60,5%), cuja distribuição de genótipo (39,5% AA, 49,9% AG e 16,6% GG) está em concordância com os estudos anteriores. Os autores relatam uma associação desse SNP nesses pacientes com uma leve baixa nos niveis de TSH, porém não com os níveis de T4 livre ou na proporção T4/T3, o que também está de acordo com a literatura. Os autores sugerem, pelos dados obtidos, que não há relação desse SNP nem com déficit intelectual e nem com os níveis séricos de hormônio tireoidianos.
No entanto, um estudo com 279 indivíduos com Transtorno Bipolar Afetivo e 284 indivíduos psiquiatricamente saudáveis na subpopulação chinesa Han reportou uma maior distribuição do alelo Ala e do alelo 3Gly do polimorfismo ORFa-Gly3Asp também no DIO2 nos indivíduos bipolares, sendo que quando as duas cópias estavam presentes, o risco para bipolaridade se mostrava aumentado, sugerindo uma possível influência da mutação em distúrbios do comportamento (HE, 2009).
Em um estudo publicado em 2015, MCANINCH et al. 2015 mostraram que, de fato, cérebros de indivíduos com a mutação Thr92Ala-D2 não apresentam alteração na expressão de genes regulados pelo T3. No entanto, a mutação leva a modificações no transcriptoma celular em cérebros humanos independentemente da sinalização do hormônio tiroidiano. O conjunto de genes que se encontra alterado está envolvido em processos relacionados ao metabolismo mitocondrial, do Complexo de Golgi, no estresse oxidativo e apoptose, sendo que o tratamento com agentes antioxidantes pode normalizar a expressão de alguns desses genes. No mesmo estudo, foi demonstrado que células que expressam a D2 com o polimorfismo Thr92Ala-D2 apresentam redução significativa na expressão do conjunto de genes envolvidos na via de sinalização do Receptor do Fator de Crescimento Epitelial (EGFR), responsável por modular o desenvolvimento cognitivo, sendo que prejuízos nela estão relacionados com a doença de Parkinson, Alzheimer e esquizofrenia.
BUROKER (2014) chama a atenção para o fato de que o alelo DIO2-T cria um sítio de ligação exclusivo para o fator de transcrição FOXC1, que ocorre apenas no DIO2 e é um importante regulador de viabilidade celular e resistência ao estresse oxidativo.
Embora não interfira com a disponibilidade de T3 no cérebro, alguns estudos sugerem que o polimorfismo Thr92Ala-D2 esteja positivamente associado a disfunções neuropsicológicas, como baixo QI (TAYLOR et al.. 2014) e bipolaridade (HE et al., 2009).
Polimorfismo ORFa-Gly3Asp
Em 2005, PEETERS et al. descreveram um novo SNP na região 5´-UTR do DIO2 (rs12885300) (NCBI, 2015) que está na sequência ORFa, composta de 3 códons e um códon de parada (MET – LYS – GLY) e resulta na mudança da glicina (GLY) por um ácido aspártico (ASP) nesse último códon (figura 2).

Em doadores de sangue saudáveis, esta mutação foi associada a níveis mais baixos de T4 no plasma, T4 livre e T3 reverso, mas não com os níveis de TSH e T3. A secreção de TSH pela hipófise é regulada a partir dos níveis de T4 circulante por feedback negativo e a D2 é essencial nesse processo. Sendo assim, PEETERS et al. (2005) sugere que a presença dessa mutação pode estar associada a um aumento da atividade da D2 na pituitária de indivíduos saudáveis, visto que foi preciso uma menor quantidade de T4 para produzir os mesmos níveis de T3. No entanto, cabe ressaltar que esse aumento na quantidade de D2 no plasma foi encontrado em adultos, mas não em idosos. Sugere-se que tal fato se dá porque a D2 é altamente expressa em tecido muscular esquelético e, em idosos, a musculatura está geralmente comprometida, com tamanho e força diminuída. Sendo assim, haveria menor expressão da D2 nesses tecidos (PEETERS et al., 2005).
Também em 2005, APPELHOF et al. avaliaram 141 pacientes com hipotiroidismo autoimune primário a fim de verificar a frequência dos polimorfismos Thr92Ala e ORFa-Gly3Asp, se há alguma relação desses polimorfismos com bem-estar e funções neurocognitivas e, por fim, se havia possível associação dos polimorfismos com preferência por terapia de reposição mista T3/T4 ao invés da monoterapia com T4 apenas. As frequências foram compatíveis com os estudos anteriores, sendo que para o polimorfismo ORFa-Gly3Asp as frequências foram de 32% em pacientes hipotireoideos versus 33,9% em indivíduos saudáveis e para o polimorfismo Thr92Ala as frequências foram de 40,4% em pacientes hipotireoideos versus 38,8% em indivíduos saudáveis. No entanto, não encontraram associação dos polimorfismos com medidas de bem-estar, funções neurocognitiva ou preferência por terapia combinada de T3/T4.
COPPOTELLI (2006) realizou a caracterização in vitro desse SNP, comparando a atividade basal de células HEK-293, GH3 e H3B, para as quais foram transferidos vetores contendo promotores clonados dos alelos selvagem e mutante. A variação mutante apresentou uma atividade basal significativamente aumentada em todas as linhagens celulares. Foi realizado um Ensaio de Desvio de Mobilidade Eletroforética, técnica utilizada para identificar a ligação de um composto a outro qualquer. Caso haja ligação, a mobilidade é retardada. Nesse teste, utilizaram extratos nucleares obtidos das células HEK-293 e de células humanas na tireoide, músculo e fígado. Foi observado que o SNP diminui a capacidade de ligação de uma proteína nuclear – um repressor - nas células HEK-293, tireoide e músculo, mas não no fígado. Os autores sugerem que o aumento na transcrição gênica induzido pelo ORFA-Gly3Asp pode ser mediado pela redução da capacidade de ligação de um repressor nuclear.
Além da associação com bipolaridade (HEN, 2009), também já foi descrito uma possível associação do ORFa-Gly3Asp e Thr92Ala com depressão crônica. Nesse estudo (GALECKA et al., 2015), realizado com 179 indivíduos diagnosticados com depressão crônica e 152 psiquiatricamente saudáveis, foi encontrado uma maior frequência do polimorfismo Thr92Ala em pacientes saudáveis, indicando que pode ser um marcador para baixo risco de depressão crônica. Polimorfismos do mesmo gene podem se encontrar próximos numa mesma localização do cromossomo, e quando são transmitidos, o são como um agrupamento e não separados. A esse conjunto chamamos de haplótipo. Foram analisados 4 haplótipos diferentes, ou seja, 4 conjuntos, e foi encontrado uma maior frequência do haplótipo TC (Thr-Gly) nos indivíduos deprimidos.
Relação entre os SNPs do gene DIO2 e cognição
Processos demenciais são caracterizados pela presença de atrofia cortical difusa, grande número de placas senis e novelos neurofibrilares, degenerações grânulo-vacuolares e perda neuronal (SMITH, 1999). A maciça perda sináptica e morte neuronal observada nas regiões cerebrais responsáveis pelas funções cognitivas, incluindo o córtex cerebral, o hipocampo, o córtex entorrinal e o estriado ventral, resultam em perda progressiva de memória, bem como comprometimento de diversas funções cognitivas, como atenção, aprendizagem, orientação, compreensão e linguagem (MELIBEU, 2012).
A concentração de placas senis está relacionada ao grau de demência apresentado. Estas são compostas pelo peptídeo beta-amilóide, fruto da clivagem da proteína APP pelas enzimas beta e gama-secretases. Estresse oxidativo associado ao acúmulo de beta-amilóide ativa uma série de quinases que hiperfosforilam a proteína Tau, resultando em emaranhados neurofibrilares e instabilidade dos microtúbulos, que podem levar à morte neuronal (WILFTANG, 2005; KIMURA, 2007; CENINI, 2012; PERLUIGI, 2014).
Os estudos de MCANINCH e BIANCO (2013) e McAninch et al., (2015) demonstraram que a mutação Thr92Ala-D2 leva a modificações no transcriptoma celular em cérebros humanos independentemente da sinalização do hormônio tiroidiano. O conjunto de genes que se encontra alterado está envolvido em processos relacionados ao metabolismo mitocondrial, do Complexo de Golgi, no estresse oxidativo e apoptose, sendo que o tratamento com agentes antioxidantes pode normalizar a expressão de alguns desses genes. O mecanismo que desencadeia quadros demenciais, como a Doença de Alzheimer, apresenta uma série de similaridades com o observado em modelos celulares da Thr92Ala-D2, como a presença de stress oxidativo levando à apoptose de, no caso, neurônios do estriado, o que explicaria seus principais sintomas. Essa similaridade sugere que portadores de polimorfismos da D2 podem possuir uma predisposição para doenças neurodegenerativas (MCANINCH et al., 2015).
A D2 pode ser encontrada no Retículo Endoplasmático de indivíduos normais. No entanto, apenas em indivíduos Thr92Ala-D2 a D2 é encontrada no Complexo de Golgi. Nesses indivíduos o complexo de Golgi apresenta uma mudança estrutural importante que pode estar relacionada ao stress nesta organela.
MCANINCH et al., (2015) também evidenciaram que células que expressam a D2 com o polimorfismo Thr92Ala-D2 apresentam redução significativa na expressão do conjunto de genes envolvidos na via de sinalização do Receptor do Fator de Crescimento Epitelial (EGFR). Esta via modula o desenvolvimento cognitivo e prejuízos nela estão relacionados com a doença de Parkinson, Alzheimer e esquizofrenia. Genes relacionados ao metabolismo da beta-amilóide também se encontraram alterados na presença dessa mutação. Em conjunto, esses achados mostram similaridades importantes entre as mudanças observadas nos indivíduos com Thr92Ala-D2 e outras doenças degenerativas do Sistema Nervoso Central, sugerindo que a presença do polimorfismo pode agir como um fator de risco em alguns indivíduos. Espera-se que em indivíduos típicos e saudáveis, hajam mecanismos compensatórios que impedem que esse SNP cause efeitos muito significativos, porém em indivíduos com predisposições à distúrbios cognitivos e doenças degenerativos, esses mecanismos podem não ser suficientes.
Em relação ao polimorfismo ORFa-GLY3ASP, as mudanças no nível sérico de hormônio tireoidiano pode ser a resposta para sua influência. No entanto, os achados são discordantes. PETTERS et al (2005) descreveram uma diminuição de T4 sérico, porém T3 normal em indivíduos adultos saudáveis homozigotos para ORFa-GLY3ASP, sugerindo um aumento na atividade da D2, COPPOTELLI et al. (2006), também descreveram um aumento na atividade da D2 em estudos in vitro, porém GEREBEN et al. (2002) relataram uma diminuição na sua atividade. De qualquer maneira, os dados mais recentes sugerem que, ao contrário do Thr92-Ala, o ORFa-Gly3Asp pode alterar a atividade catalítica da D2. Essas alterações podem acarretar em mudanças nos níveis de T3, seja aumentando ou diminuindo, o que pode trazer impactos diretos para o bem-estar cognitivo dos indivíduos afetados.
Conclusão
Os estudos com os SNPs do gene DIO2 e depressão, ansiedade, bipolaridade e déficits cognitivos são relativamente novos e de caráter correlacional, sendo que o primeiro foi publicado em 2004 (GUO, 2004). Inicialmente a hipótese era de que o polimorfismo Thr92Ala poderia causar alguma alteração na atividade catalítica na D2 e isso explicaria possíveis consequências para o comportamento. Os estudos mais recentes mostram que essa alteração catalítica não acontece, porém que há mudanças consideráveis no transcriptoma celular no cérebro. É uma possibilidade que indivíduos típicos e saudáveis possuam mecanismos compensatórios que impeçam ou minimizem os possíveis efeitos da expressão diferenciada dos genes afetado e que indivíduos com comprometimentos clínicos sejam mais susceptíveis. No entanto, essa é uma teoria que necessita ser analisada mais profundamente.
Ainda há poucos estudos que elucidam por quais mecanismos esses SNPs atuam, que impactos causam na população típica e atípica e seu papel nos distúrbios cognitivos e transtornos de humor. A continuidade desses estudos é de extrema importância para compreendermos melhor a etiologia e desenvolvimento dessas condições.
Referências
ABREU, G.P.P.D. A importância da tiróide nas perturbações da mente. 2011. 72f. Dissertação (Mestrado em Medicina). Universidade Da Beira Interior, Corvilhã [ Links ].
APPELHOF, B. C. et al. Polymorphisms in type 2 deiodinase are not associated with well-being, neurocognitive functioning, and preference for combined thyroxine/3,5,3- triiodothyronine therapy. Journal of Clinical Endocrinology and Metabolism, v. 90, n. 11, p. 6296–6299, 2005.
BAHLS S.C.; DE CARVALHO, G.A. The relation between thyroid function and depression: a review. Rev Bras Psiquiatr, v. 26, p. 41-49, 2004depression: a review. Revista Brasileira de Psiquiatria, v. 26, n. 1, p. 41-49, 2004.
BERBEL, P. et al. Role of thyroid hormones in the maturation and organisation of rat barrel cortex. Neuroscience, v. 107, n. 3, p. 383-394, 2001. [ Links ]
BERNAL, J.; NUNEZ, J.. Thyroid hormones and brain development. European Journal of Endocrinology, v. 133, n. 4, p. 390-398, 1995. [ Links ]
BIANCO, A.C.; KIM, B.W. Deiodinases: implications of the local control of thyroid hormone action. Journal of Clinical Investogation, v. 116, p. 2571-2579, 2006. [ Links ]
BUROKER, N. E. Regulatory SNPs and transcriptional factor binding sites in ADRBK1, AKT3, ATF3, DIO2, TBXA2R and VEGFA. Transcription, v. 5, n. 4, p. e964559, 2014. [ Links ]
CENINI, G. et al. Association between frontal cortex oxidative damage and beta-amyloid as a function of age in Down syndrome. Biochimica et biophysica acta, v. 1822, n. 2, p. 130–8, fev. 2012.
COPPOTELLI, Giuseppe et al. Functional characterization of the 258 A/G (D2-ORFa-Gly3Asp) human type-2 deiodinase polymorphism: a naturally occurring variant increases the enzymatic activity by removing a putative repressor site in the 5'UTR of the gene. Thyroid, v. 16, n. 7, p. 625-632, 2006.
CROTEAU, W.; DAVEY, J.C.,; GALTON, V.A.; ST.GERMAIN, D.L. Cloning of the mammalian type II iodothyroninedeiodinase. A selenoprotein differentially expressed and regulated in human and rat brain and other tissues. Journal of Clinical Investigation, v. 98, p. 405-417, 1996. [ Links ]
DORA, J. M. et al. Association of the type 2 deiodinase Thr92Ala polymorphism with type 2 diabetes: case-control study and meta-analysis. European journal of endocrinology / European Federation of Endocrine Societies, v. 163, n. 3, p. 427–34, 2010.
GAŁECKA, E. et al. Association of the DIO2 gene single nucleotide polymorphisms with recurrent depressive disorder. TC, v. 62, n. 2, p. 297–302, 2015.
GANGULI, M. et al. Association between dementia and elevated TSH: a community-based study. Biological psychiatry, v. 40, n. 8, p. 714-725, 1996. [ Links ]
GEREBEN, B. et al. The mRNA structure has potent regulatory effects on type 2 iodothyronine deiodinase expression. Molecular Endocrinology, v. 16, n. 7, p. 1667-1679, 2002. [ Links ]
GUO, T.W. et al. Positive association of the DIO2 (deiodinase type 2) gene with mental retardation in the iodine-deficient areas of China. Journal of medical genetics, v. 41, n. 8, p. 585–590, 2004.
HE, B. et al. Association of genetic polymorphisms in the type II deiodinase gene with bipolar disorder in a subset of Chinese population. Progress in NeuroPsychopharmacology and Biological Psychiatry, v. 33, n. 6, p. 986–990, 2009.
KIMURA, R. et al. The DYRK1A gene, encoded in chromosome 21 Down syndrome critical region, bridges between β-amyloid production and tau phosphorylation in Alzheimer disease. Human Molecular Genetics, v. 16, n. 1, p. 15–23, 2007.
MCANINCH, E. A. et al. Prevalent polymorphism in thyroid hormone-activating enzyme leaves a genetic fingerprint that underlies associated clinical syndromes. The Journal of Clinical Endocrinology & Metabolism, v. 100, n. 3, p. 920-933, 2015. [ Links ]
MCANINCH, E. A.; BIANCO, A. C. The Thr92AlaD2 Polymorphism May Play a Novel Role in Hypothyroidism. Thyroid Disorders Editorial v. 34, p. 31–33, 2015.
MEYER, E.L.S. et al. Expressão das iodotironinas desiodases nas neoplasias tireoidianas. Arquivos Brasileiros de Endocrinologia & Metabologia, v. 51, (5), p. 690-700, 2007. [ Links ]
MELIBEU, A. Nicotina, Alzheimer e Plasticidade: o que eles têm em comum? Encontro Ciências e Cognição, v. 30, n. 1, p. 0–0, 2012.
MENTUCCIA, D. et al. Association Between a Novel Variant of the Human Type 2 Deiodinase Gene Thr92Ala and Insulin Resistance. Diabetes, v. 51, n. 3, p. 880–883, 2002.
MORREALE DE ESCOBAR, G. et al. Role of thyroid hormone during early brain development. European journal of endocrinology / European Federation of Endocrine Societies, v. 151 Suppl , p. U25–37, 2004.
NAIR, S. et al. Association analyses of variants in the DIO2 gene with early-onset type 2 diabetes mellitus in Pima Indians. Thyroid, v. 22, n. 1, p. 80-87, 2012. [ Links ]
NUNES, M.T . Regulação Neuroendócrina da Função Tireoidiana. In: Neuroendocrinologia Básica e Aplicada. 1 ed. Rio de Janeiro: Guanabara-Koogan, 2005, v., p. 249-278. [ Links ]
PAPI, G. et al. Subclinical hypothyroidism. Curr Opin Endocrinol Diabetes Obes, v. 14, p. 197-208, 2007. [ Links ]
PEETERS, R.P. et al. Polymorphisms in thyroid hormone pathway genes are associated with plasma TSH and iodothyronine levels in healthy subjects. J Clin Endocrinol Metab, v.88(6), p. 2880-2888, 2003. [ Links ]
PEETERS, R. P. et al. A new polymorphism in the type II deiodinase gene is associated with circulating thyroid hormone parameters A new polymorphism in the type II deiodinase gene is associated with circulating thyroid hormone parameters. Am J Physiol Endocrinol Metab, v. 289, n. February 2005, p. 75–81, 2005.
PERLUIGI, M. et al. Unraveling the complexity of neurodegeneration in brains of subjects with Down syndrome: Insights from proteomics. Proteomics - Clinical Applications, v. 8, n. 1-2, p. 73–85, 2014.
RODRIGUES, S.G.; GUERRA, M.; SOARES-FORTUNATTO, J.M. Papel das hormonas tireoideias no desenvolvimento intelectual. Revista Portuguesa de Psicossomática, v. 5(2), p. 117-125, 2003. [ Links ]
SETIAN, N. S. Hypothyroidism in children: diagnosis and treatment. Jornal de pediatria, v. 83, n. 5 Suppl, p. S209–S216, 2007.
SMITH, M. D. A. C. Doença de Alzheimer. Revista Brasileira de Psiquiatria, v. 21, p. 3–7, 1999.
TAYLOR, P. et al. Effect of low thyroid hormone bioavailability on childhood cognitive development: data from the Avon Longitudinal Study of Parents and Children birth cohort. The Lancet, v. 383, p. S100, 2014. [ Links ]
TURIANITSA, I.M et al. Status of the thyroid gland in patients with schizophrenia. Zh Nevropatol Psikhiatr Im S S Korsakova, v. 91, p. 122-123, 1991. [ Links ]
VERLOOP, H. et al. Genetic variation in deiodinases: a systematic review of potential clinical effects in humans. European Journal of Endocrinology, v. 171, n. 1, p. 123–135, 2014.
WAGNER, M.D.S. Expressão das Iodotironinas Desiodases Tipos I e II em Diferentes Tecidos de Camundongos Normais e com Deficiência Inata para a Desiodase tipo I. 2001. Tese (Doutorado em Fisiologia).100f. Universidade Federal do Rio Grande do Sul, Porto Alegre. [ Links ]
WIERSINGA, W.M. Adult hypothyroidism. South Dartmouth (MA): Endocrine Education Inc. [online], p.11-31, 2013. Disponível em: http://www.thyroidmanager.org/chapter9/0-frame.htm [Acessado em 02 de abril de 2016].
WILTFANG, J. et al. Consensus paper of the WFSBP Task Force on Biological Markers of Dementia: the role of CSF and blood analysis in the early and differential diagnosis of dementia. The world journal of biological psychiatry : the official journal of the World Federation of Societies of Biological Psychiatry, v. 6, n. 2, p. 69–84, 2005.
ZHANG, K. et al. A family-based association study of DIO2 and children mental retardation in the Qinba region of China. Journal of human genetics, v. 57, n. 1, p. 14-17, 2012. [ Links ]
ZEVENBERGEN, Chantal et al. Functional analysis of novel genetic variation in the thyroid hormone activating type 2 deiodinase. The Journal of Clinical Endocrinology & Metabolism, v. 99, n. 11, p. E2429-E2436, 2014.
Submissão: 29.04.2016
Aceitação: 21.07.2016














