Serviços Personalizados
Journal
artigo
Indicadores
Compartilhar
Cuadernos de neuropsicología
versão On-line ISSN 0718-4123
Cuad. neuropsicol. v.3 n.1 Santiago maio 2009
ORIGINALES Y REVISIONES
Neurociencia en Psiquiatria; hacia una medicina integral y personalizada en el DSM-V: una propuesta
Neuroscience in Psychiatry towards an integrative and personalized medicine in the DSM-V: a proposal
Carlos Augusto Novo Olivas1; Erick Emmanuel Pérez Solís2
Asociación de Neurociencia Integral AplicadaI
NovoBrainI
NeuroScopic I; II
RESUMEN
En el último siglo la concepción de salud, y con ello de la ciencia médica, ha sufrido un cambio profundo, ontogénico, metanoico. Sin embargo, esta revolución no ha alcanzado de la misma manera a lo que hoy en día llamamos salud mental. En las siguientes páginas se tratará de mostrar, tomando como modelo al Trastorno Depresivo Mayor (TDM), la posibilidad y necesidad que tiene la psicopatología (comportamiento y capacidades “mentales”: intelectivas, racionales, cognitivas, ejecutivas, lingüísticas, emocionales, lógico-conceptuales, etc.), de regresar a sus orígenes médicos, que le permitirán responder al “cómo” del funcionamiento cerebral y a su relación con el resto del organismo y con el medio ambiente, con el fin de obtener patrones que nos ayuden a definir enfermedad desde una perspectiva etiofisiopatogénica. Ha llegado el momento de cuestionar si hemos inventado una ciencia (psiquiatría) que poco tiene que ver con la realidad, por lo que se propone la creación de bases de datos donde se integren variables biológicas (genéticas, cerebrales, endocrinológicas, inmunológicas, etc.), sociales, personales, clínicas, etc., de forma multicéntrica e internacional, para finalmente obtener relaciones que nos permitan una reclasificación de la patología cerebral útil para proporcionar tratamientos integrales y personalizados.
Palabras clave: DSM-V; Neurociencia; Psiquiatría; Neurobiología; Cerebro; Medicina personalizada.
ABSTRACT
In the last Century the concept of health and, with it, medical science, has suffered a profound, conceptual and ontological change. However, this revolution has not reached, in the same way the field of mental health. In the next pages it will be shown, taking Major Depressive Disorder as a model, how it is possible and necessary, for the field of psychopathology (behavior and “mental” functions: rational, executive, cognitive, emotional, etc.) the return to its medical origins, which will allow it to respond how the brain functions and its interactions with the rest of the organism and the environment, with the goal of obtaining patterns that will help us to define disease from an etiopathogenic point of view, so it would be possible to provide therapeutic options to the organ in question. The time has come to ask if we have invented a science (psychiatry) that has little to do with reality, and to answer that, the creation of multicentric data bases is proposed, in which biological (not just brain based), social, personal, clinical, etc. variables are integrated, to finally obtain correlations that allow us a reclassification of brain pathology that would be useful to offer integral and personalized treatments.
Keywords: DSM-V; Neuroscience; Psychiatry; Neurobiology; Brain; Personalized medicine.
Introducción
“El hombre tiene que saber que del cerebro, y del cerebro solamente, emergen nuestros placeres, alegrías, risas y diversiones, así como nuestros pesares, dolores, quejas y lágrimas. A través de él…nosotros…pensamos, vemos, escuchamos y distinguimos lo horrible de lo bello, lo bueno de lo malo, lo agradable de lo desagradable”.
Hipócrates, 400 a.C. (Traducción del autor)
“La última meta es un sistema de clasificación diagnóstica para los desórdenes mentales que esté basado no solamente en síntomas clínicos, sino también en la etiología y patofisiología de los desordenes”.
Steven E. Hyman, 2007 (Traducción del autor)
Desde escritos como el Talmud y el Antiguo Testamento ya se le atribuían a diferentes órganos como el corazón, intestinos, riñones, etc. la génesis de sentimientos, emociones, deseos, impulsos, pasiones y pensamientos entre otras actividades “mentales” (1). En el siglo XVII con los trabajos de Willis, y un par de siglos después con las observaciones de Darwin, Broca y James, entre otros, la esencia teórica de la neurociencia moderna comenzó a vislumbrarse; pero no fue hasta a comienzos del siglo XX, con Ramón y Cajal y Sherrington (2), que los procesos mentales comenzaron a encontrar una explicación biológica adecuada y real (3). Y mientras el resto de la ciencia médica se aleja de una práctica fenomenológica, la psiquiatría no ha logrado desprenderse de este cordón umbilical insuficiente y atrófico, que sin embargo, puede llegar a ser una herramienta de cierta utilidad para el clínico, como complemento, pero sobretodo es un área para la filosofía de la mente o neurofilosofía (4,5).
A pesar de las evidentes dificultades ontológicas, grandes pasos se han dado en los últimos 120 años (6). Ha llegado el momento de cuestionar si se ha inventado una ciencia que poco tiene que ver con la realidad o si se ha construido un campo de conocimiento basado en información real, física, lógica, comprobable y repetible (aunque siempre circunstancial). Se hace eco a las palabras de Hyman con las que concluye su artículo en el 2007, y que parece, de alguna manera, refutar argumentos como el de Charney (7), que asegura que la psiquiatría no ha encontrado marcadores neuro biológicos útiles:
“… no es muy temprano para utilizar la neurobiología como herramienta central para repensar el acercamiento actual a los desordenes mentales, y para comenzar con algunos cuidadosos experimentos que podrían liberar a la ciencia de las indeseables consecuencias del hecho de materializar los diagnósticos actuales que probablemente no reflejan la naturaleza” (realidad). Traducción e itálicas del autor.
La metamorfosis y la reconstrucción de una psiquiatría basada en procesos etiopatológicos comenzó, con una perspectiva multidisciplinaria, a mediados de los 50’s en el Instituto de Walter Reed de la Armada Americana, en donde dos grupos de científicos, liderados por McKenzie Rioch integraron investigación del comportamiento humano con investigaciones cerebrales; una década después el programa de Investigación de Neurociencia en el MIT dio inicio y la fundación del primer departamento de neurobiología en Harvard cierra la primera etapa de la nueva ciencia cerebral (8); desde entonces este proceso ha sido lento y nebuloso. Sin embrago, todo indica que el tiempo ha llegado para integrar marcadores biológicos en psiquiatría, y se pretende que sean tomados en cuenta en el futuro Manual Diagnóstico Estadístico (DSM, por sus siglas en inglés), entre otros cambios esenciales que sufrirá (7,9-11, www.dsm5.org).
La necesidad de acercarnos a definiciones, conceptos, clasificaciones y categorías - no sólo dimensionales, sino fisiopatológicas, correlacionando síntomas (datos subjetivos) con signos (datos objetivos), con una metodología personalizada - parece ser un imperativo categórico, que tendrá impacto en todas las esferas y niveles de las ciencias relacionadas al funcionamiento cerebral. Este podría ser el principio del fin de la psiquiatría sintomatológica categórica, y el nacimiento de la medicina personalizada en salud cerebral, utilizando herramientas como la fármacogenética (12), neurogenética (13, 14), neuroimagen (15,16), neurofisiología (17,18), neuroinmunoendocrinología (13,19), neuroinformática (20), nanotecnología (21,22), neuroquímica molecular (23), modelos matemáticos neuronales (24,25), modelos teóricos de física quántica (26), etc.; así como la implementación integral de éstas y otras herramientas (2,3,16,27), para de manera eficaz y real, lograr clasificar, diagnosticar, definir, prevenir, evitar, tratar y pronosticar procesos neuropatológicos (7,10). Así pues la neurociencia clínica promete revolucionar la psiquiatría moderna, encontrando procesos etifisiopatológicos, desde una perspectiva multidisciplinaría e integral (8,27-30), proponiendo marcadores biológicos en diferentes sistemas con su adecuada correlación clínica, logrando así diagnósticos fenotípicos. Sin embargo, quedan varias décadas de andanzas e innumerables “molinos-gigantes” que derrotar; en las que no se debe perder de mira conceptos y reglas éticas, pues son esenciales para obtener resultados de real y segura utilidad para el ser humano, siempre respetando su naturaleza individual e irrepetible (31).
Objetivos
El objetivo es plantear nuevos panoramas y oportunidades en neurociencia clínica, con un enfoque integral, donde las áreas biológicas como la genética, endocrinológica, inmunológica, metabólica, molecular, neurofisiológica, etc. no estén en conflicto con factores y variables clínicos conductuales y cognitivosemocionales, socio - culturales y ambientales.
La realidad es que todos los factores tienen un impacto en la persona y en el sistema orgánico corporal, y el cerebro es el órgano esencial (32) donde se llevan a cabo los procesos que hacen posible el “ser” y “quehacer” humano.
Ahora bien, el fin primordial de este breve resumen es exponer un amplio universo de información que, a pesar de las innumerables dificultades, muestra que se deben buscar marcadores cerebrales y biológicos, porque existen, y existen simplemente porque el órgano enfermo es el encéfalo, aunque no siempre directamente o de manera etio y ontogénica. Esta idea absoluta y categórica, no es, ni debería ser nunca, excluyente; sino simplemente ordenadora y catalizadora para dicho fin: encontrar anormalidades de función, estructura cerebral y sistémica en todos los niveles, que permitan hablar de etiofisiopatogenia en psiquiatría. La patología cerebral debe aproximarse de manera similar a la patología gástrica, en donde, las causas principales son exógenas (ej. alcohol, medicamentos), sin embargo no se considera, ni se describe como una enfermedad dietética o nutricional, sino de la mucosa del estomago.
Así pues, además de plantear ideas bases y datos científicos que comuniquen una visión integral de la psiquiatría, especialmente un enfoque donde siempre se considere al cerebro con sus múltiples relaciones como el órgano a tratar, se propone una metodología que haga esto posible en los siguientes años. Se afirma con seguridad que éste es el futuro de, lo que ya comienza a ser, la nueva ciencia cerebral y se auguran innumerables aplicaciones en todos los campos y niveles de la patología cerebral (7,10,11). Con el fin de mostrar y clarificar el objetivo del presente trabajo, se tomará como modelo al TDM.
Desarrollo
Se ha olvidado que las teorías psicológicas, basadas en métodos filosóficos, han sido originalmente creadas como modelos temporales en espera de herramientas y métodos que pudieran darles claridad y bases biológicas. Sin embargo, con el paso del tiempo fueron adoptadas como teorías definitivas. Así, conceptos filosóficos se modificaron aplicándose a conceptos “psicológicos” que se intentaron correlacionar con funciones biológicas; dando como resultado una ciencia corrupta, una amalgama disfuncional y extremadamente confusa. Con esto no se pretende que las distintas disciplinas no se complementen, si no todo lo contrario, pero jamás perdiendo sus límites. Este es uno de los peligros que corre la nueva ciencia neuronal, pues su nombre nos describe claramente cual es el objeto de estudio; sin embargo, se siguen presentando estructuras lingüísticas y conceptuales contradictorias y muchas veces ridículas, como “psicobiología”, en donde se unen dos conceptos excluyentes: espíritu y cuerpo (excluyentes en sentido conceptual y lógico). No existe manera alguna de medir biológicamente y cuantitativamente lo que por definición no es físico y por lo tanto no cuantificable con métodos físicos.
Es difícil no compartir lo que el mismo William James dijo sobre su obra The Principles of Psychology (Principios de Psicología):
“Nadie puede estar más molesto que yo al ver el libro. ¡Ningún objeto merece ser tratado en 1000 páginas! Si tuviera diez años más, lo podría reescribir en 500; pero por el momento es esto o nada – una repugnante, distendida, hinchada, abultada, edematizada masa, testificando dos cosas: 1era, que no existe tal cosa como la ciencia psicológica, y 2da, que W.J. es un inepto” (33). (Traducción del autor).
Muy posiblemente lo dijo sarcásticamente, sin embargo, lo realmente sarcástico es que no lo es. No se busca destruir a la psicología como campo (como Nietzsche hizo categóricamente en su Ocaso de los Ídolos), sólo se desea una claridad, pureza y limitación en la ciencia, para que pueda darnos lo que es capaz de proporcionarnos, no más y nunca menos. Freud, treinta años después en su Beyond the Pleasure Principle (Más allá del Principio del Placer), da la impresión de recordar esta moción de James y parece complementarla argumentando:
“La biología es realmente una tierra de posibilidades ilimitadas. Podemos esperar que nos de la información más sorprendente y no podemos augurar qué respuestas nos dará en unas cuantas docenas de años… Pueden ser del estilo que destruye por completo las estructuras artificiales de nuestras hipótesis”. (Freud, 1920; Citado en Kandel (34). (Traducción del autor).
Sin embargo, Freud pensó que ciertas ideas (“analogías, correlaciones y conexiones”), eran dignas de consideración, por lo que se rechaza el concepto que vislumbra una ciencia biológica destructora, demoledora (“blow away”, del texto original); por el contrario, es un hecho que la biología ha dado y dará un sustento a las hipótesis psicológicas exógenas, otorgando un valor empírico, desvelando los conceptos artificiales y subjetivos de la psicología.
El cerebro es necesario para, y de su funcionamiento depende, el comportamiento humano en todos sus niveles y en todos los campos, desde genéticos - moleculares, celulares, microsistemas, macrosistemas, organismo, hasta socio - ambientales, etc. Así pues, la neurociencia clínica pretende descubrir patrones cerebrales en todos los niveles, y su relación con el resto de los sistemas, que nos permitan definir un mal funcionamiento, para poder “normalizarlo” (tratarlo) y ser capaces de vaticinar el futuro más probable.
La falta de consenso sobre qué marcadores endógenos y clínicos (exógenos) son válidos para el diagnóstico y elección de tratamiento en trastornos cerebrales (psiquiátricos) , es uno de los problemas esenciales de dicho campo. Estas dificultades, posiblemente, tienen su origen en la increíble complejidad del comportamiento humano y la enorme cantidad de variables que parecen afectar nuestras habilidades. Esto ha puesto en evidencia nuestras herramientas y métodos de estudio, que proporcionan respuestas tan variadas e inconstantes como la información clínica que ya poseemos hoy en día. Parece lógica la desilusión y frustración al no encontrar patrones útiles en la práctica clínica y observar la enorme brecha entre el laboratorio y la vida fuera de éste, sin embargo, esto es causa de la falta de modelos adecuados que integren variables múltiples que hacen posible la construcción de puentes que unan los mecanismos biológicos en todos los niveles y sistemas, a las entidades clínicas, y que permitan definir el funcionamiento “normal” (10).
A continuación se describirán y discutirán posibles marcadores en el TDM, actualmente un síndrome categórico, lo que se considera una forma inadecuada y falaz para lograr encontrar correlaciones, pues se parte de un argumento a priori que asegura que dicho síndrome tiene una base fisiológica auténtica, estable, homogénea y específica (y simplemente no es así); por lo que la primera propuesta es hacer correlaciones con síntomas, no síndromes, de manera dimensional y no categórica (11,35-37), y olvidar suposiciones diagnósticas existentes, con el fin de encontrar procesos patofisiologicos que puedan explicar expresiones clínicas.
Marcadores Genéticos
Comenzando con las leyes de Mendel y posteriormente con el descubrimiento de la “doble hélice” del DNA de Crick y Watson (y Wilkins), que les valió el premio Nobel en 1962, se han tratado de encontrar correlaciones causales genéticas en trastornos neuropsiquiátricos. Sin embargo, la euforia inicial (común en la historia del humano) de dichos descubrimientos está llegando a una madurez científica, y el “genetismo” desaparece lentamente, para darle cabida a una medicina integral y personalizada, donde las variables genéticas son, simplemente, parte del increíble rompecabezas humano, la comprensión etiológica de los desordenes psiquiátricos necesitan una perspectiva integradora que integre distintas perspectivas (30,38). En su artículo de 1967 sobre la genética de la esquizofrenia, Gottesman y Shields usaron el término endofenotipo por primera vez para definir una característica relacionada a una enfermedad (28), comprobable a través de diversos métodos, pero que no es visible de manera externa, patrones entre los genes y la dermis. Posteriormente Gershon y Goldin en 1986 describieron 4 criterios útiles para la identificación de endofenotipos (en donde es esencial su comportamiento hereditable o genético) y desde entonces intentos de encontrar marcadores genéticos relevantes han sido pobres e inconsistente, poniendo en duda si realmente existe tal concepto; afortunadamente algunos candidatos genéticos (ej. CREB, BDNF) continúan teniendo atractivas correlaciones a pesar de las metodologías dispares y que se toma como base de correlación a síndromes categóricos heterogéneos, manteniendo la puerta abierta en el campo de la genética.
Otro punto importante a mencionar es considerar que posiblemente el tipo de correlaciones lineales que se intentan descubrir entre el comportamiento y sus bases genéticas no existen, por lo que métodos y herramientas que permitan modelos correlacionales no lineales (ej. teoría del caos) son necesarios.
También es importante aclarar que difícilmente existen genes únicos que pueda causar un trastorno psiquiátrico específico, de hecho, es ampliamente aceptable la contribución de múltiples genes susceptibles a ciertos estímulos del medio (tanto interno como extracorpóreo) los que hacen posible el desarrollo de procesos patológicos conductuales, una excelente revisión es la de Lesch (39). Y por último, las técnicas actuales de correlaciones con enlaces genéticos, sólo utilizando ciertos genes o regiones, son menos poderosas y necesitan una gran cantidad de sujetos para encontrar correlaciones significativas por lo que se propone estudiar correlaciones con el genoma completo (whole-genome linkage), buscando polimorfismos únicos en nucleótidos, aunque existen aún dudas sobre el poder de estos (40). (Ver Tabla 1)
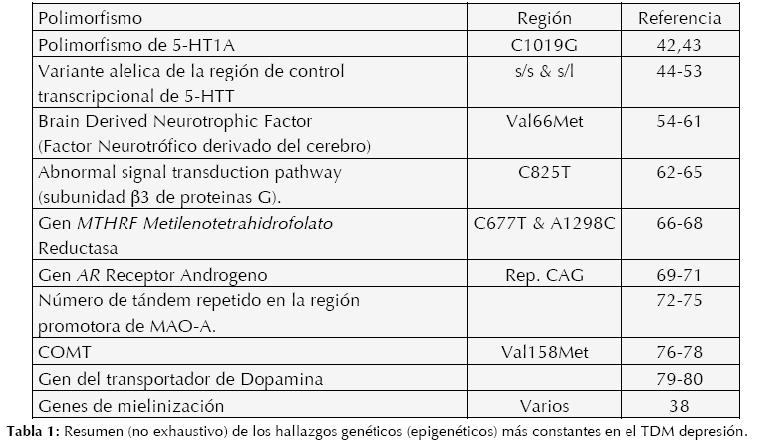
Es importante recordar que existen variadas metodologías, no sólo técnicas, también estadísticas y conceptuales que complican el tema, se refiere a Hasler (41) para una discusión del tema; sin embargo, la integración de genotipos, endofenotipos y fenotipos, a través del tiempo y evolución, prometen una reclasificación, personalizada, de la patología neuropsiquiátrica que tendrá impacto real en la practica diaria del profesional de dicha área.
Se puede encontrar una recopilación más exhaustiva de posibles marcadores o correlaciones genéticas en Hattori (81).
Marcadores Inmunológicos
El sistema inmune es uno de los sistemas menos comprendidos en la ciencia médica, y su relación con otros sistemas y órganos es todavía más incierta, aunque es bien aceptado su importante impacto en todos ellos. Sin embargo, cabe mencionar que desde hace más de dos décadas han existido hipótesis derivadas de la observación de correlaciones de procesos inmunológicos y funcionamiento cerebral (82,83), fuertemente relacionas, sobre todo, con procesos endocrinológicos, tanto que se ha formado un campo en donde se toma como un sólo sistema, regulado por el cerebro, llamado (psico) neuroinmunoendocrinología (84-86).
Actualmente, temas como la relación mente-cuerpo, o la unión de medicina occidental con conceptos orientales o inclusive posibles explicaciones postmodernas sobre la espiritualidad y salud, se han hecho posibles gracias a la existencia del sistema inmune. Conceptos tan básicos como estrés son ahora entendidos como procesos biológicos que afectan el comportamiento humano y que nos hacen posible ser conscientes de la sensación de enfermedad (ej. gripe común), y como ésta afecta nuestra conducta y habilidades cognitivas, emocionales y sociales.
Así pues, el sistema inmune ha comenzado a fungir como un enlace que hace posible el diálogo entre disciplinas o visiones opuestas (o por lo menos muy distintas), así como la mecánica quántica aplicada a función neuronal es el puente entre el problema de cerebro-conciencia; inclusive podemos asegurar que hay un relación entre ambos problemas y conceptos, pero ahora nos interesa un enfoque principalmente clínico.
La relación que existe entre procesos estresantes y patología en general es una de esas leyes que la humanidad ha tenido sin poder comprobar de manera objetiva, por lo que ha tratado de explicarla con múltiples suposiciones, la mayoría de ellas dándole un gran énfasis a la espiritualidad del hombre, inclusive como prueba de ella.
Actualmente las ciencias biológicas han encontrado en el sistema inmune el candidato perfecto para explicar la relación entre estímulos negativos y enfermedad. Y más recientemente su impacto en el tejido cerebral.
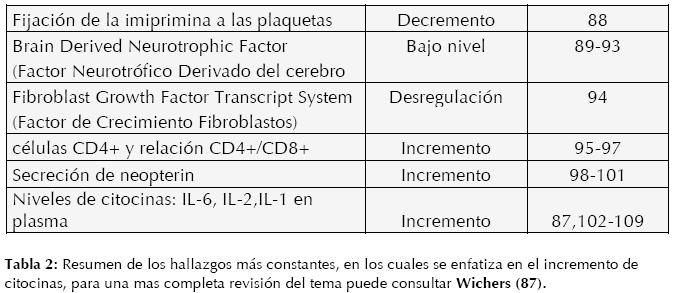
Hoy en día uno de los modelos etiofisiopatológicos más aceptados del TDM es aquel que considera al estrés como disparador o causa de las manifestaciones clínicas propias del TDM, así como su íntima relación con trastornos de ansiedad, trastornos cardiovasculares, gástricos, metabólicos, degenerativos, etc. para una revisión se recomienda Marques-Deak (82). Y se propone al sistema inmunológico como la base molecular de los efectos cerebrales, tanto de manera directa (ej. citocinas) e indirecta (endocrinológicos) por sus características sistémicas. (Ver tabla 2)
Marcadores Endocrinológicos
Continuando con la visión integradora de Frank Beach (110), y más recientemente de muchos otros con perspectivas integracionistas, como el modelo biopsicosocial de Engel de 1977, y otros modelos psicofisiológicos, genético-moleculares (11,30,111). Cabe aclarar que la correlación más importante ha sido desde hace décadas con el sistema hipotálamo-pituitario-adrenal (HPA), donde todos sus componentes han sido encontrados culpables; sin embargo, el más consistente y de mayor impacto, posiblemente, ha sido el cortisol (112,113), el cual constantemente se encuentra elevado y/o resistente a la inhibición con esteroides sintéticos (dexametasona).
Como se ha comentado anteriormente la interrelación entre el sistema inmune y endocrino parece esencial en el proceso fisiopatológico del TDM, donde la interacción bidireccional con el sistema serotoninérgico, especialmente en estructuras “límbicas” cerebrales, parece un punto de unión entre las anormalidades estructurales y funcionales cerebrales y la expresión clínica de dicho trastorno, se recomienda el trabajo de Myint (114). Con esta breve explicación se enlistan algunas referencias de importancia. (Ver Tabla 3)

Marcadores Neurofisiológicos (EEG, ERP).
No fue hasta principios del siglo XX con Berger que el electroencefalograma contemporáneo nació y comenzó a tomar relevancia en áreas de salud y comportamiento humano (128), siendo, históricamente, la herramienta más utilizada para mediciones de funcionamiento cerebral. Sus características temporales son inigualables, mientras que el problema de localización (“problema aplicables muy prometedores o que inclusive ya han demostrado su eficacia y utilidad convirtiendo al electroencefalograma (EEG) en una herramienta de imagen cerebral funcional (129-131) con múltiples aplicaciones (132-137).
Además la capacidad que da el EEG para utilizarse en combinación con otras herramientas de imagen funcional (“neuroimagenmultimodal”) como resonancia magnética funcional (138,139), tomografía por emisión de protones, PET (132,140), magnetoencefalografía, MEG (141,142), tomografía de emisión de protón único, SPECT (129), espectroscopia de rayos casiinfrarojos, NIRS (143,144), resonancia magnética de difusión tensora, DTI (145,146), entre otras, permiten pronosticar un cambio significativo dentro de neuroimagen funcional en la próxima década.
La medición de potenciales eléctricos extracraneal tanto en reposo como durante actividad, es una de las ciencias más complejas, en donde múltiples variables técnicas y metodológicas son esenciales y capaces de modificar los resultados enormemente (ej. el montaje de los electrodos), sin tomar en cuenta las dificultades intrínsecas de la actividad electrofísica, especialmente en tejidos vivos, y sus relaciones no lineales tanto a nivel micro como macroscópico y éstas con representaciones clínicas; por lo que algunos autores han concluido que la actividad captada por el EEG es simplemente un epifenómeno cerebral, sin embargo no podemos llegar a tales conclusiones simplemente por ignorancia del fenómeno, además de que ha sido ampliamente rebatido desde diferentes perspectivas (147,148).
En los últimos 40 años, con los avances en tecnología digital y en unión de herramientas matemáticas adecuadas, ha sido posible obtener mayor información de la actividad generada cerebralmente. Estas transformaciones matemáticas (ej. Fourier) de la actividad electroencefálica han hecho posible la cuantificación objetiva de dicha actividad, naciendo así el EEG cuantitativo, abriendo una puerta a un campo que apenas madura, con la creación de las primeras bases de datos tanto normativas como clínicas de funcionamiento cerebral y sus relaciones con conducta, surgiendo así la primera herramienta paraclínica de funcionamiento cerebral con aplicación clínica hace más de treinta años, a la cual se llamó Neurometrics (149).
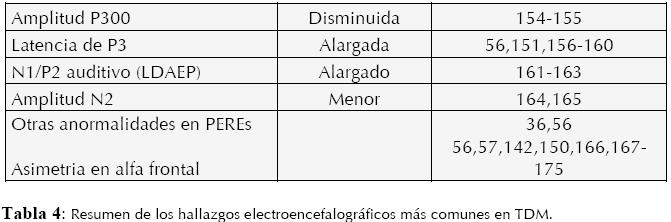
La alta resolución temporal del EEG permite obtener información en el orden de milisegundos, una característica única dentro de las herramientas de funcionamiento cerebral. Esta particularidad hace posible captar actividad eléctrica cerebral evocada por estímulos externos o secundarios a procesos cognitivos, a lo que se le llama Potencial Evocado Relacionado a Eventos (PEREs). Los PEREs son complejos de ondas que se suelen clasificar en tiempo y direccionalidad (negativas y positivas), y pueden ser sensoriales, motores o cognitivos, estos últimos son los que tienen utilidad en procesos neuropatológicos como el TDM (17).
Aunque la relación entre actividad electroencefalográfica (EEG y PEREs) y diferentes hallazgos estructurales, funcionales, neuropsicológicos, genéticos, clínicos, farmacológicos, etc., se han reportado, no es el fin de esta monografía describirlos, para esto se refiere al lector a (10,56,57,150- 153). (Ver Tabla 4)
Marcadores de Neuroimagen Estructural
Con el descubrimiento de los rayos-x, que le valió el premio Nobel a Wilhelm Conrad, a finales del siglo XIX, las herramientas de imagen comenzaron su historia. Hace más de 35 años la neuroimagen dio su primer salto significativo con el primer aparato de tomografía computarizada, desarrollado por Hounsfield (por lo que se le otorgó el premio Nobel en 1979) y unos años después, en 1975, Richard Ernst proponía las bases físico-matemáticas para la resonancia magnética (RM o MRI), que hasta la actualidad se utiliza, y por lo que fue galardonado con el premio Nobel en 1991, un par de años antes del desarrollo de la RM funcional (176).
El ser humano tiene una increíble capacidad de búsqueda y una casi ilimitada creatividad, que ha hecho posible no sólo viajar fuera de nuestra atmosfera terrestre sino dentro de nuestro universo corporal. Desde siglos atrás, la fascinación con la estructura cerebral ha generado múltiples teorías de funcionamiento, basadas en descripciones anatómicas fruto de autopsias, tanto en animales como en humanos. Hoy en día contamos con herramientas no invasivas que nos hacen posible ver a través del cráneo en busca de anormalidades estructurales cada vez más pequeñas y con mayor resolución.
Las anormalidades estructurales en el TDM parecen ser determinadas por la cronicidad y el número de crisis depresivas así como su severidad (177) como en el hipocampo ycorteza prefrontal, en donde es común encontrar atrofia, mientras que suele encontrarse un aumento de volumen en región de complejo amigdalino (178), por lo que parece esencial obtener datos clínicos de la historia y evolución del padecimiento. Cabe mencionar que estos cambios estructurales también se observan en procesos de estrés severos, lo cual es una razón más para pensar en una causa o fisiopatología base para ambos síndromes clínicos, lo que comentaremos más adelante. (Ver Tabla 5).

Marcadores de Función Cerebral por Imagen
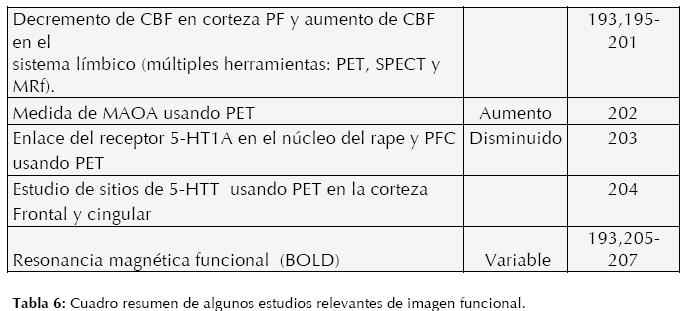
La década de los 90’s ha sido el parte aguas en neurociencia con la introducción de herramientas de imagen cerebral tales como la RM funcional (RMf), Tomografía por Emisión de Positrones (PET), Tomografía Computarizada de Protón Único (SPECT) y con la declaración del gobierno estadounidense de la década del cerebro. En los últimos 10 años las herramientas de imagen cerebral funcional se han multiplicado, como herramientas que utilizan tecnología nuclear (RM de Difusión Tensora), tecnología óptica (NIRS), tecnología molecular (espectroscopía con RM), técnicas que utilizan estimulación extracraneal, etc. lo cual promete una revolución conceptual en las ciencias cerebrales, especialmente en psiquiatría, buenas revisiones han sido elaboradas por Drevets (193), Gordon (16), Honey (15) y Broderick (176).
Las anomalías estructurales en el TDM no han sido de la contundencia esperada, innumerables resultados contradictorios o simplemente no contundentes dieron paso a la nueva era de imagen cerebral, que no sólo se interesaba en la estructura sino en la funcionalidad, midiendo una gran cantidad de variables como el flujo sanguíneo cerebral (CBF, por sus siglas en inglés), metabolismo de glucosa, niveles de oxigenación sanguínea (BOLD, por sus siglas en inglés), receptores y enzimas de neurotransmisores, entre otros. Lo cual generó una gran cantidad de información que permitía correlacionar datos clínicos con hallazgos anormales de función en regiones específicas del cerebro. Las áreas que más comúnmente se reportan con anormalidades funcionales corresponden a estructuras “límbicas” como la amígdala, la corteza del cíngulo, estructura hipocampal, corteza parahipocampal y corteza prefrontal.
Desgraciadamente la especificidad es aún considerada baja para trastornos neuropsiquiátricos, ya que muchas de las anormalidades son compartidas con un gran abanico de trastornos clínicos (ej. esquizofrenia y trastornos de ansiedad) y la falta de estudios con aplicaciones clínicas (ej. respuesta al tratamiento) hacen imposible consensos de uso, lo cual desmotiva a los especialistas a utilizarlos regularmente en la práctica clínica. Estos obstáculos, que son en mayor parte metodológicos, pueden y deben ser superados con relativa facilidad desarrollando correlaciones sintomatológicas, no sindromáticas, correlaciones con variables clínicas, cognitivas, endocrinológicas, metabólicas e inmunológicas; así como la utilización de métodos estadísticos adecuados. Inclusive cabe mencionar que la compañía Brain Resource Company (BRC) ha logrado crear la primera y única (de nuestro conocimiento) base de datos integral (genética, imagen estructural, EEG, neuropsicología y clínica) que consiste en más de quince mil sujetos, tanto sanos (normativos) como enfermos (depresión, esquizofrenia, déficit de atención, demencia, etc.) (194, 10). Se considera de gran importancia el uso de técnicas múltiples (“multimodal”), que puedan aportar información simultánea del funcionamiento cerebral desde perspectivas distintas. (Ver Tabla 6)
Marcadores Clínicos
Los síntomas y signos en medicina han sido, lentamente, desplazados por la tecnología, lo que pasa “intradérmicamente” parece ser más interesante, y muchas veces más revelador; sin embargo la investigación científica nunca ha dejado de poner atención y resaltar la importancia de la medicina clínica, especialmente de aquellos datos estables y objetivos; pero por otra parte, nuestros sentidos siempre han sido insuficientes para conocernos y detectar la enfermedad, por lo que hemos inventado herramientas que ayuden a nuestros sentidos.
En el campo de patología cerebral, con ciertas excepciones, los métodos clínicos son, aún, la única forma de obtener información para realizar un diagnóstico y elegir un tratamiento.
Sin embargo, la heterogeneidad diagnóstica que puede resultar utilizando modelos sintomatológicos, como el DSM, es enorme, por lo que pierde valor como sistema o herramienta diagnóstica, tema de constante crítica desde hace décadas, para revisiones del tema se refiere a Parker (208), Gruenberg (209) y Lyuten (210).
A continuación (Tabla 7) se mencionarán las características clínicas más importantes y estables en lo que hoy día se conceptualiza como trastorno (síndrome) depresivo.
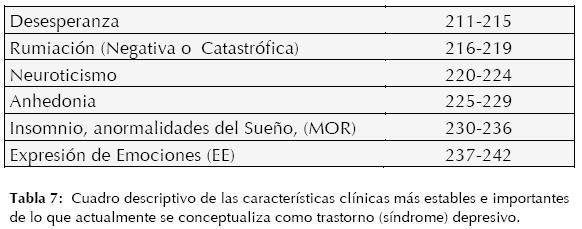
Marcadores Neurocognitivos
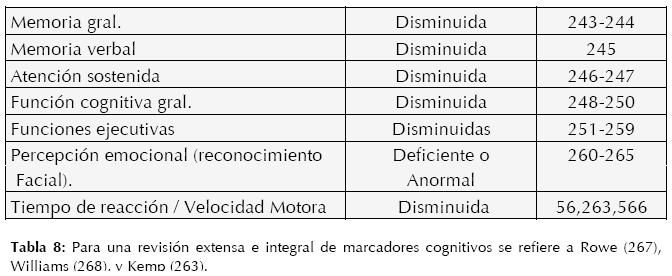
Las herramientas diagnósticas obtienen su valor por su constancia para detectar o descartar cierta patología, su sensibilidad y especificidad. Desgraciadamente aún no se ha encontrado una herramienta única que sea capaza de arrojar un diagnóstico específico y estable en neuropatología; sin embargo, la combinación de herramientas clínicas y paraclínicas, tanto fisiológicas como no-fisiológicas, ha demostrado su impacto y utilidad (10). Dentro de las herramientas paraclínicas nofisiológicas se encuentran las baterías y pruebas neuropsicológicas, en donde se miden habilidades y comportamientos humanos de manera estable y basados en normas, las cuales son sumamente útiles, sobretodo por su sensibilidad diagnóstica.
Los hallazgos neuropsicológicos no sólo no están en conflicto con otras herramientas de imagen y función cerebral, sino que nos permiten unir lo intradérmico con lo extra corpóreo; inclusive se han encontrado anormalidades histopatológicas en las mismas estructuras anatómicas donde se observan datos disfuncionales con imagen (ej. amígdala, corteza prefrontal, hipocampo, tálamo anterior, etc.), comprobando la relación que existe entre datos anormales histológicos, de imagen cerebral y cognitivos-conductuales.
Marcadores Socio-Culturales (ambientales)
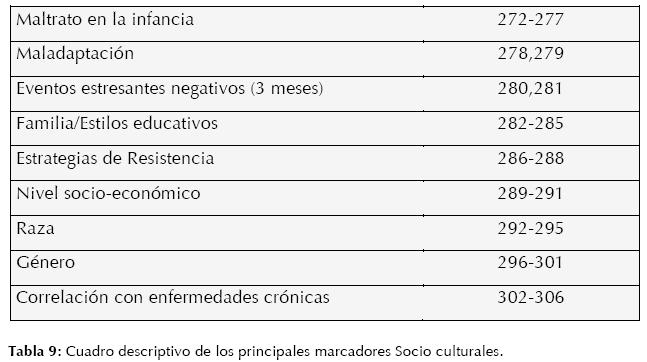
“Los procesos relacionales son integrales a la biología de base de los trastornos mentales” (9). No existe hoy en día un tema en las ciencias cerebrales con más impacto que el de la relación del medio ambiente y el funcionamiento cerebral y sus respectivos efectos en los distintos sistemas corporales a diferentes niveles y, finalmente, en el comportamiento humano (203). Dentro de las variables extrapersonales, y en estrecha correlación con el individuo con más impacto, son los procesos de estrés (269,270), especialmente aquellos durante los primeros años de vida e inclusive desde la vida intrauterina (271).
Las circunstancias socio-culturales son tan determinantes como la carga genética del individuo, inclusive se puede asegurar una comunicación bidireccional entre estos dos universos (el intracelular y el sociocultural), una idea muy antigua que ahora podemos darle una explicación biológica y que promete, con esto, darle una mayor relevancia a dichas circunstancias, con el fin de manipularlas y prevenir y tratar procesos fisiopatológicos (específicamente cerebrales). (Ver Tabla 9)
Marcadores Histopatológicos
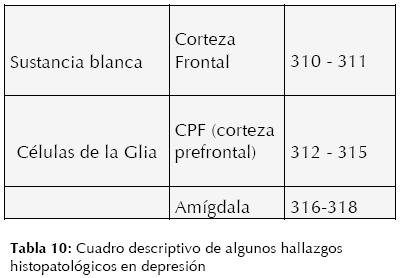
En el último siglo y después de casi medio siglo desde que Cochrane propuso una nueva forma de abordar la enfermedad y su diagnóstico, sus ideas siguen siendo una realidad, se le ha dado más importancia al tratamiento que al diagnóstico de las enfermedades, e inclusive se ha perdido de vista las bases metodológicas diagnósticas, o por lo menos no se ha invertido la misma energía en la construcción de teorías y conceptos para el diagnóstico (307). Es bien aceptado que la primera regla en medicina, propuesta desde los griegos, es “no hacer daño”; sin embargo, esto es sumamente difícil si no se tiene un diagnóstico apropiado, así pues la primera regla en medicina es obtener un diagnóstico correcto.
Esto no es de manera alguna una tarea sencilla en la mayoría de las enfermedades, a pesar de los esfuerzos en las últimas décadas para formar una medicina “basada en evidencia” y de encontrar la “regla de oro” (método idóneo) para un diagnóstico, que parece ser siempre parcial y dependiente de factores humanos, inclusive aquellos que se consideran objetivos, como es la histopatología (308).
Así pues, ante esta gran brecha en la ciencia médica (posiblemente la más grande y esencial), la cual seguramente se irá acortando con una visión “integracionista” y personalizada del ser humano y sus procesos patológicos, se presentan hallazgos histopatológicos en depresión (309,196). (Ver Tabla 10)
La heterogeneidad de los trastornos neuropsiquiátricos, especialmente el TDM, invitan a pensar que las herramientas que hasta el momento se han utilizado para describir dicho trastorno no son las adecuadas; sin embargo, actualmente es posible integrar una gran cantidad de variables estables que nos permitirán obtener patrones de funcionamiento y estructura tanto normal como anormal, en todos los niveles (genético, molecular, celular, neuroquímico, conductual, etc.), con el fin de proporcionar diagnósticos integrales que nos lleven a tratamientos no sólo farmacológicos personalizados y eficaces.
Los modelos etiofisiopatológicos que se pueden derivar de estos y otros datos, pueden ser complejos y poco claros, pero aun así, es posible describir un posible prototipo que integre el mayor número de variables (sin pretender profundizar mucho en esto, que no es el objetivo del presente trabajo) y finalmente proponer una posible solución que nos permita obtener patrones útiles.
El punto de partida son los genes, estos determinan de manera relativa la estructura y funcionamiento del organismo, el cual interactúa con el medio externo de una manera bidireccional. Así pues, la presencia de polimorfismos genéticos (ej. BDNF, CREB, etc.), que predispongan a procesos degenerativos o que causen una neuroprotección deficiente o inhiban funciones de regeneración, crecimiento y maduración (neurogénesis, sinpatogénesis, etc.), en estructuras cerebrales (hipocampo, amígdala, corteza del cíngulo, etc.), son la primera variable a tomar en cuenta. Sin embargo, la predisposición no es causal suficiente, y parece necesario, también, un proceso de estrés que desencadene el proceso fisiopatológico (inmunoendocrinológico), que producirá daños funcionales (ej. RMf, EEG, etc.) y estructurales (RM, histopatología, etc.), que finalmente ocasionarán el cuadro clínico y los hallazgos cognitivo-conductuales (desde trastornos del sueño y apetito hasta conductas perseverantes y autodestructivas).
Este modelo ha sido ampliamente comentado anteriormente desde distintas perspectivas por Pittenger (319), Mayberg (320) y Leonard (321), pero nunca con una visión tan integral como la que se expone; no es el objetivo de este trabajo plantear un modelo exhaustivo, sino proponer una metodología que nos permita perfeccionar dicho modelo fisiopatológico, y que permita nuevas y mejores soluciones terapéuticas personalizadas.
El TDM, como todos los trastornos neuropsiquiátricos, tiene como característica esencial su heterogeneidad y variabilidad clínica (y muchas veces paraclínica), no sólo entre sujetos, sino en un mismo paciente a través del tiempo; lo que ha causado intensa crítica sobre los métodos diagnósticos actuales y la elección de tratamiento, que resultan mediocremente eficaces, seguramente por el pobre diagnóstico. Teniendo en cuenta todo lo anterior proponemos la creación de bases de datos que permitan correlacionar múltiples variables, a través del tiempo en grandes poblaciones multicéntricas.
Esta metodología ha sido puesta en marcha de manera más reducida por Brain Resource Company (BRC), desde hace ya más de 7 años, con resultados (10) que nos permiten asegurar que un modelo integral es posible, es útil y debe ser ampliado y mejorado con las variables ya mencionadas, entre otras.
Conclusión
Estamos ante el mayor de los retos de la historia humana, la descripción de nosotros mismos, y para ello parece que sólo poseemos de una herramienta, de un sólo método, que a su vez es el objeto mismo. El conocimiento del humano se puede hacer desde puntos distintos, que no deben verse como excluyentes, sino complementarios. Y así como es importante conocer sobre las huellas en el cerebro que dejan las sensaciones experimentadas, ante las cuales somos meros espectadores (Immanuel Kant, “Antropología”), también es esencial discurrir sobre aspectos no-fisiológicos y encontrar cierta unión entre ambas ciencias para ser más que espectadores.
Se han descrito sólo algunas variables que se deben tener en cuenta para estructurar un modelo realista integral y personalizado del funcionamiento cerebral y comportamiento humano; sin embargo, existen otros posibles marcadores en diferentes niveles y sistemas que también pueden y deben tomarse en cuenta que no hemos mencionado, como ciclos circadianos, estructura del sueño, medidas de neuropeptidos y hormonas sexuales, metabolitos de neuromoduladores en líquido cefalorraquídeo; así como hallazgos utilizando otras herramientas de imagen funcional (NIRS, MEG, MRS, DTI, etc.) y otras medidas fisiológicas extracerebrales, y muchas otras intracerebrales que por el momento no conocemos o no es posible medirlas (marcadores intracelulares, enzimáticos, etc.).
Se propone la creación de bases de datos integradoras y personalizadas, multicéntricas, internacionales y multiculturales, para lograr correlaciones significativas en todos los niveles biológicos y su impacto (interrelaciones) en el ambiente, en el tiempo y espacio; donde la neurogenética, la neurociencia molecular y celular, la neurociencia del desarrollo, la neuroendocrinología, neuroinmunología, la neurociencia del comportamiento (emocional y cognitiva) y sus relaciones interpersonales (neurociencia social), con la ayuda de la neuroinformática y estadística; para obtener modelos adecuados de funcionamiento y patología cerebral, que deberán estar contemplados en el DSM-V a comienzos de la siguiente década.
Referencias
1. Panksepp, J. (2004). Textbook of Biological Psychiatry. WILEY-LISS. [ Links ]
2. Martin, J. (2002). The integration of neurology, psychiatry, and neuroscience in the 21st century. Am J Psychiatry, 159(5), 695-704. [ Links ]
3. Blackmore, C. (2005 December 10- 16). In Celebration of Cerebration. The Lancet, 366(9502), 2035-57. [ Links ]
4. Varela, F. (1999). Naturalizing phenomenology: issues in contemporary phenomenology and Cognitive Science (pp.266-329). Standford University Press. [ Links ]
5. Rudrauf, D., Lutz, A., Lachaux, J., & Le Van Quyen, M. (2003). From autopoiesis to neurophenomenology: Francisco Varela's exploration of the biophysics of being. Biol. Res 36(1), 27- 65. [ Links ]
6. Posner, M., Kandel, E., Albright, T., & Jessell, T. (2000). Neural science: review a century of progress and the mysteries that remain. Neuron, 25:1–55. [ Links ]
7. Kupfer, J., First, M., & Regier, D. (2002). A Research Agenda for DSM – V. American Psychiatric Association. Version digital en: [ Links ]http://www.appi.org/pdf/kupfer_2292.pdf
8. Cowan, W., Kopnisky, K., & Hyman, S. (2002). The Human Genome Project and Its Impact on Psychatry. Annu Rev Neurosci, 25:1-50. [ Links ]
9. Beach S, (2006) Relational Processes and DSM – V, Neuroscience, Assessment, Prevention and Treatment. American Psychiatric Publishing. [ Links ]
10. Gordon, E. (2007). Integrating objective gene-brain-behavior markers of psychiatric disorders. J Integr Neurosci, 6(1), 1-34. [ Links ]
11. Hyman, S. (2007). Can neuroscience be integrated into the DSM-V?. Nature Reviews Neurosci, 8(9), 725-732. [ Links ]
12. Shastry, B. (2006). Pharmacogenetics and the Concept of Individualized Medicine. The Pharmacogenomics J, 6(1), 16–21. [ Links ]
13. Sadock, B., Sadock, V., (2007). Synopsis of Psychiatry. LWW. [ Links ]
14. Flint, J., & Munafo, M. (2006). The endophenotype concept in psychiatric genetics. Psychological Med, 37(2), 163- 80. [ Links ]
15. Honey, G. (2002). Functional brain mapping of psychopathology. J Neurol Neurosurg Psychiatry, 72(4), 432–439. [ Links ]
16. Gordon, E. (2002). Neuroimaging in neuropsychiatry. Sin publicar. [ Links ]
17. Cacioppo, J., Tassinary, L., & Bernston, G., (2005). Handbook of Psychophysiology. Cambridge University Press. [ Links ]
18. Lopez-Ibor, J., Gaebel, W., Maj, M., & Sartorius, N. (2002). Psychiatry as a neuroscience. WILEY. [ Links ]
19. Webster, J., Tonelli, L., & Sternberg, E. (2002). Neuroendocrine regulation of immunity. Annu Rev Immunol, 20:125- 63. [ Links ]
20. Koslow, S. (2005). Discovery and integrative neuroscience, Clin EEG Neurosci, 36(2), 55-63. [ Links ]
21. Silva, A. (2006). Neuroscience nanotechnology: progress, opportunities and challenges. Nature Rev Neurosci, 7(1), 65-74. [ Links ]
22. Jain, K. (2007). Applications of nanobiotechnology in clinical diagnostics, Clin Chemistry 53(11), 2002- 9. [ Links ]
23. Deutch, A., & Roth, R. (2004). Neurochemical Systems in the Central Nervous System. en: Charney, D., & Nestler, E. (Eds.) Neurobiology of Mental Illness. Oxford University Press. [ Links ]
24. Nunez, P., & Srinivasan, R. (2007). Electric fields of the brain, The Neurophysics of EEG. Oxford University Press. [ Links ]
25. Izhikevich, E., Gally, J., & Edelman, G. (2004). Spike-timing dynamics of neuronal groups. Cereb Cortex, 14(8), 933-944. [ Links ]
26. Freeman, W. (2003). Neurodynamic models of brain in psychiatry. Neuropsychopharmacology, 28(1), 54- 63. [ Links ]
27. Kandel, E. (1998). A new intellectual framework for psychiatry. Am J Psych, 155(4), 457-469. [ Links ]
28. Gottesman, I., & Gould, T. (2003). The endophenotype concept in psychiatry: etymology and strategic intentions, Am J Psychiatry, 160(4), 636– 645. [ Links ]
29. Kendler, K. (2006). Reflections on the relationship between psychiatric genetics and psychiatric nosology, Am J Psychiatry, 163(7), 1138–1146. [ Links ]
30. Kendler, K. (2008). Explanatory models for psychiatric illness. Am J Psychiatry, 165(6), 695-702. [ Links ]
31. Farah, M., & Wolpe, P. (2004). Monitoring and manipulating brain function: new neuroscience technologies and their ethical implications, Hastings Cent Rep, 34(3), 35-45. [ Links ]
32. Rakic, P. (2004). En Gazzaniga, M., (Ed.) The Cognitive Neurosciences III (pp.3-4). MIT Press. [ Links ]
33. Fancher, R. (1996). Pioneers of Psychology (pp. 247). New York: W.W. Norton & Company. [ Links ]
34. Kandel, E. (2006). In Search of Memory, The Emergence of a New Science of Mind (pp. 53). W. W. Norton. [ Links ]
35. Pearlson, G., & Folley B. (2008). Endophenotypes, dimensions, risks: Is psychosis analogous to common inherited medical illnesses?. Clin EEG Neurosci, 39(2), 73-77. [ Links ]
36. Mössner, R., Mikova, O., Koutsilieri, E., Saoud, M., Ehlis, A., Müller, N., et al (2007). Consensus paper of the WFSBP Task Force on Biological Markers: Biological Markers in Depression. World J Biol Psychiatry, 8(3), 141-174. [ Links ]
37. Helzer, J. Kreamer, H., Krueger, R., Wittchen, H., Sirovatka, P., & Regier, D.A (2008). Dimensional Approaches in Diagnostic Classification: Refining the Research Agenda for DSM-V. American Psychiatric Association. [ Links ]
38. Le-Niculescu, H., Kurian, S., Yehyawi, N., Dike, C., Patel, S., Edenberg, H., et al (2008). Identifying blood biomarkers for mood disorders using convergent functional genomics. Mol Psychiatry, Epub ahead of print 1–19. [ Links ]
39. Lesch, K. (2004) Geneenvironment interaction and the genetics of depression. J. Psychiatry Neurosci, 29(3), 174-84. [ Links ]
40. Levinson, D. (2005). The Genetic of Depression: A Review. Biol Psychiatry, 60(2), 84-92. [ Links ]
41. Hasler, G., Drevets, W., Manji, H., Charney D. (2004) Discovering endophenotypes for major depression. Neuropsychopharmacology, 29(10), 1765-81. [ Links ]
42. Lemonde, S., Turecki, G., Bakish, D., Du, L., Hrdina, P., & Bown, C. (2003). Impaired repression at a 5- hydroxytryptamine 1A receptor gene polymorphism associated with major depression and suicide. J Neurosci, 23(25), 8788-8799. [ Links ]
43. Wu, S., & Comings, D. (1999) A common C-1018G polymorphism in the human 5-HT1A receptor gene. Psychiatr Genet, 9(2), 105-106. [ Links ]
44. Caspi, A., Sugden, K., Moffitt, T., Taylor, A., Craig, I., Harrington, H., et al (2003). Influence of life stress on depression: moderation by a polymorphism in the 5-HTT gene. Science, 301(5631), 386-389. [ Links ]
45. Greenberg, B., Li, Q., Lucas, F., Hu, S., Sirota, L., Benjamin, J., et al (2000). Association between the serotonin transporter promoter polymorphism and personality traits in a primarily female population sample. Am J Med Genet, 96(2), 202-216. [ Links ]
46. Neumeister, A., Konstantinidis, A., Stastny, J., Schwarz, M., Vitouch, O., Willeit, M., et al (2002). Association between serotonin transporter gene promoter polymorphism (5HTTLPR) and behavioral responses to tryptophan depletion in healthy women with and without family history of depression. Arch Gen Psychiatry, 59(7), 613-620. [ Links ]
47. Kendler, K., Kuhn, J., & Vittum, J. (2005). The interaction of stressful life events and a serotonin transporter polymorphism in the prediction of episodes of major depression. Arch Gen Psychiatry 62(5), 529-535. [ Links ]
48. Cervilla, J., Rivera, M., Molina, E., Torres-González, F., Bellón, J., Moreno, B., et al (2006) The 5-HTTLPR s/s genotype at the serotonin transporter gene (SLC6A4) increases the risk for depression in a large cohort of primary care attendees: The PREDICT-Gene study. Am J Med Genet B (Neuropsychiatr Genet), 141B(8), 912-917. [ Links ]
49. Sen, S., Burmeister, M., & Ghosh, D. (2004). Meta-analysis of the association between a serotonin transporter promoter polymorphism (5-HTTLPR) and anxietyrelated personality traits. Am J Med Genet B Neuropsychiatr Genet, 127(1), 85-89. [ Links ]
50. Hariri, A., Mattay, V., Tessitore, A., Kolachana, B., Fera, F., Goldman, D., et al (2002). Serotonin transporter genetic variation and the response of the human amygdala. Science, 297(5580), 400-403. [ Links ]
51. Pezawas, L., Meyer-Lindenberg, A., Drabant, E., Verchinski, B., Munoz, K., Kolachana, B., et al (2005). 5-HTTLPR polymorphism impacts human cingulated-amygdala interactions: a genetic susceptibility mechanism for depression. Nat Neurosci, 8(6), 828-834. [ Links ]
52. Gonda, X., Rihmer, Z., Juhasz, G., Zsombok, T., & Bagdy, G. (2007). High anxiety and migraine are associated with the s allele of the 5HTTLPR gene polymorphism. Psychiatry Res, 149(1-3), 261-266. [ Links ]
53. Munafo, M., Clark, T., & Flint, J. (2005). Does measurement instrument moderate the association between the serotonin transporter gene and anxiety related personality traits? A meta-analysis. Mol Psychiatry, 10(4), 415–419. [ Links ]
54. Hashimoto, K., Shimizu, E., & Iyo, M. (2004). Critical role of brain-derived neurotrophic factor in mood disorders. Brain Res Brain Res Rev, 45(2), 104-114. [ Links ]
55. Sen, S., Nesse, R., Stoltenberg, S., Li, S., Gleiberman, L., Chakravarti, A., et al (2003) A BDNF coding variant is associated with the NEO personality inventory domain neuroticism, a risk factor for depression. Neuropsychopharmacology, 28(2), 397- 401. [ Links ]
56. Gatt, J., Clark, C., Kemp, A., Liddell, B., Dobson-Stone, C., Kuan, S., et al (2007). A genotype-endophenotypephenotype path model of depressed mood: integrating cognitive and emotional markers. J Integr Neurosci, 6(1), 75-104. [ Links ]
57. Gatt, J., Kuan, S., Dobson-Stone, C., Paul, R., Joffe, R., Kemp, A., et al (2008). Association between BDNF Val66Met polymorphism and trait depression is mediated via resting EEG alpha band activity. Biol Psychol, 79(2), 275-284. [ Links ]
58. Hwang, J., Tsai, S., Hong, C., Yang, C., Lirng, J., & Yang, Y. (2006) The Val66Met polymorphism of the brainderived neurotrophic-factor gene is associated with geriatric depression. Neurobiol Aging, 27(12), 1834-1837. [ Links ]
59. Jiang, X., Xu, K., Hoberman, J., Tian, F., Marko, A., Waheed, J., et al (2005). BDNF variation and mood disorders: a novel functional promoter polymorphism and val66met are associated with anxiety but have opposing effects. Neuropsychopharmacology 30(7), 1353- 1361. [ Links ]
60. Neves-Pereira, M., Mundo, E., Muglia, P., King, N., Macciardi, F., & Kennedy, J. (2002). The brain-derived neurotrophic factor gene confers susceptibility to bipolar disorder: evidence from a family-based association study. Am J Hum Genet, 71(3), 651-655. [ Links ]
61. Manji, H., Martinowich, K., & Lu, B. (2007). New insights into BDNF function in depression and anxiety. Nature Neurosci, 10(9), 1089-1093. [ Links ]
62. Zill, P., Baghai, T., Zwanzger, P., Schüle, C., Minov, C., Riedel, M., et al (2000). Evidence for an association between a G-protein beta3-gene variant with depression and response to antidepressant treatment. Neuroreport, 11(9), 1893-1897. [ Links ]
63. Serretti, A., Lorenzi, C., Cusin, C., Zanardi, R., Lattuada, E., Rossini, D., et al (2003). SSRIs antidepressant activity is influenced by G beta 3 variants. Eur Neuropsychopharmacol 13(2), 117-122. [ Links ]
64. Bondy, B., Baghai, T., Zill, P. Bottlender, R., Jaeger, M., Minov C, et al (2002). Combined action of the ACE Dand the G-protein beta3 T-allele in major depression: a possible link to cardiovascular disease?. Mol Psychiatry, 7(10), 1120-1126. [ Links ]
65. Exton, M., Artz, M., Siffert, W., & Schedlowski, M. (2003). G protein beta3 subunit 825T allele is associated with depression in young, healthy subjects. Neuroreport, 14(3), 531-533. [ Links ]
66. Gilbody, S., Lewis, S., & Lightfoot, T. (2006). Methylenetetrahydrofolate reductase (MTHFR) genetic polymorphisms and psychiatric disorders: a HuGE review. Am J Epidemiol, 165(1), 1-13. [ Links ]
67. Bjelland, I., Tell, G., Vollset, S., Refsum, E., & Ueland, P. (2003). Folate, vitamin B12, homocysteine, and the MTHFR 677CT polymorphism in anxiety and depression. Arch Gen Psychiatry, 60(6), 618-626. [ Links ]
68. Coppen, A., & Bolander-Gouaille, C. (2005). Treatment of depression: time to consider folic acid and vitamin B12. J Psychopharmacol, 19(1), 59-65. [ Links ]
69. Seidman, S., Araujo, A., Roose S., & McKinlay, J. (2001). Testosterone level, androgen receptor polymorphism, and depressive symptoms in middle aged men. Biol Psychiatry, 50(5), 371-6. [ Links ]
70. Colangelo, L., Sharp, L., Kopp, P., Scholtens, D., Chiu, B., Liu, K., et al (2007). Total testosterone, androgen receptor polymorphism, and depressive symptoms in young black and white men: The CARDIA Male Hormone Study. Psychoneuroendocrinology, 32(8-10), 951-8. [ Links ]
71. Geng, Y., Su, Q., Su, L., Chen, Q., Ren, G., Shen, S., et al (2007). Comparison of the polymorphisms of androgen receptor gene and estrogen alpha and beta gene between adolescent females with first-onset major depressive disorder and controls. Int J Neurosci, 117(4), 539-47. [ Links ]
72. Kersting, A., Kroker, K., Horstmann, J., Baune, B., Hohoff, C., Mortensen, L., et al (2007). Association of MAO-A variant with complicated grief in major depression. Neuropsychobiology, 56(4), 191-196. [ Links ]
73. Schulze, T., Muller, D., Krauss, H., Scherk, H., Ohlraun, S., Syagailo, Y., et al (2000). Association between a functional polymorphism in the monoamine oxidase A gene promoter and major depressive disorder. Am J Med Genet, 96(6), 801-803. [ Links ]
74. Yu, Y., Tsai, S., Hong, C., Chen, T., Chen, M., & Yang, C. (2005). Association study of a monoamine oxidase a gene promoter polymorphism with major depressive disorder and antidepressant response. Neuropsychopharmacology, 30(9), 1719-1723. [ Links ]
75. Ho, L., Furlong, R., Rubinsztein, J., Walsh, C., Paykel, E., Rubinsztein, D. (2000). Genetic associations with clinical characteristics in bipolar affective disorder and recurrent unipolar depressive disorder. Am J Med Genet, 96(1), 36-42. [ Links ]
76. Massat, I., Souery, D., Del-Favero, J., Nothen, M., Blackwood, D., Muir, W., et al (2005). Association between COMT (Val158Met) functional polymorphism and early onset in patients with major depressive disorder in a European multicenter genetic association study. Mol Psychiatry, 10(6), 598-605. [ Links ]
77. Jabbi, M., Kema, I., van der Pompe, G., te Meerman, G., Ormel, J., & den Boer, J. (2007). Catechol-omethyltransferase polymorphism and susceptibility to major depressive disorder modulates psychological stress response. Psychiatric Genet, 17(3), 183-193. [ Links ]
78. Funke, B., Malhotra, A., Finn, C., Plocik, A., Lake, S., Lencz, T., et al (2005). COMT genetic variation confers risk for psychotic and affective disorders: a case control study. Behav Brain Funct, 18:1-19. [ Links ]
79. Haeffel, G., Getchell, M., Koposov, R., Yrigollen, C., Deyoung, C., Klinteberg, B., (2008). Association between polymorphisms in the dopamine transporter gene and depression: evidence for a gene-environment interaction in a sample of juvenile detainees. Psychol Sci, 19(1), 62-69. [ Links ]
80. Garriock, H., Delgado, P., & Kling, M. (2005). Number of risk genotypes is a risk factor for major depressive disorder: a case control study. Behav Brain Funct, 5:2-24. [ Links ]
81. Hattori, E., Liu, C., Zhu, H., & Gershon, E. (2005). Genetic test of biologic systems in affective disorders. Mol Psychiatry, 10:719-740. [ Links ]
82. Marques-Deak, A., Cizza, G., & Sternberg, E. (2005). Brain-immune interactions and disease susceptibility. Mol psychiatry, 10(3), 239-250. [ Links ]
83. Charmandari, E., Tsigos, C., & Chrousos, G. (2005). Endocrinology of the stress response. Annu Rev Physiol, 67:259-284. [ Links ]
84. Blalock, J. (1997). Neuroimmuno endocrinology. Karger-Basel. [ Links ]
85. Santiago, J. (2001). Un salto paradigmático: de la red psiconeuro inmunoendócrina al modelo biocognitivo de la salud. Segundo congreso virtual de psiquiatría, Interpsiquis 2001. Mesa redonda: Psicosomática. [ Links ]
86. Demas, G. (2004) The energetics of immunity: a neuroendocrine link between energy balance and immune function. Horm Behav, 45(3), 173-180. [ Links ]
87. Wichers M., Schiepers O., Maes M. (2005) Cytokines and Major depression. Prog Neuropsychopharmacol Biol Psychiatry, 29(2), 201-17. [ Links ]
88. Ellis, P., & Salmond, C. (1994). Is platelet imipramine binding reduced in depression? A meta-analysis. Biol Psychiatry, 36(5), 292-299. [ Links ]
89. Lang, U., Hellweg, R., & Gallinat, J. (2004). BDNF serum concentrations in healthy volunteers are associated with depression related personality traits. Neuropsychopharmacology, 29(4), 795- 798. [ Links ]
90. Shimizu, E., Hashimoto, K., Okamura, N., Koike, K., Komatsu, N., Kumakiri, C., et al (2003). Alterations of serum levels of brain-derived neurotrophic factor (BDNF) in depressed patients with or without antidepressants. Biol Psychiatry, 54(1), 70-75. [ Links ]
91. Karege, F., Perret, G., Bondolfi, G., Schwald, M., Bertschy, G., & Aubry, J. (2002). Decreased serum brain-derived neurotrophic factor levels in major depressed patients. Psychiatry Res, 109(2), 143-148. [ Links ]
92. Karege, F., Bondolfi, G., Gervasoni, N., Schwald, M., Aubry, J., & Bertschy, G. (2005). Low brain-derived neurotrophic factor (BDNF) levels in serum of depressed patients probably results from lowered platelet BDNF release unrelated to platelet reactivity. Biol Psychiatry, 57(9), 1068-1072. [ Links ]
93. Aydemir, O., Deveci, A., & Taneli, F. (2005). The effect of chronic antidepressant treatment on serum brainderived neurotrophic factor levels in depressed patients: a preliminary study. Prog Neuropsychopharmacol Biol Psychiatry, 29(2), 261-265. [ Links ]
94. Evans, S., Choudary, P., Neal, C., Li, J., Vawter, P., Tomita, H., et al (2004). Dysregulation of the fibroblast growth factor system in major depression. PNAS, 101(43), 15506–15511. [ Links ]
95. Maes, M., Stevens, W., DeClerck, L., Bridts, C., Peeters, D., Schotte, C., et al (1992). Immune disorders in depression: higher T helper/T suppressor-cytotoxic cell ratio. Acta Psychiatr Scand, 86(6), 423-431. [ Links ]
96. Müller, N., Hofschuster, E., Ackenheil, M., Mempel, W., & Eckstein, R. (1993). Investigations of the cellular immunity during depression and the free interval: evidence for an immune activation in affective psychosis. Prog Neuropsychopharmacol Biol Psychiatry, 17(5), 713-730. [ Links ]
97. Zorrilla, E., Luborsky, L., McKay, J., Rosenthal, R., Houldin, A., Tax, A., et al (2001). The relationship of depression and stressors to immunological assays: a meta-analytic study. Brain, Behav Immun, 15(3), 199-226. [ Links ]
98. Duch, D., Woolf, J., Nichol, C., Davidson, J., & Garbutt, J., (1984). Urinary excretion of biopterin and neopterin in psychiatric disorders. Psychiatry Res, 11(2), 83-89. [ Links ]
99. Dunbar, P., Hill, J., Neale, T., & Mellsow, P. (1992). Neopterin measurement provides evidence of altered cell-mediated immunity in patients with depression, but not with schizophrenia. Psychol Med, 22(4), 1051- 1057. [ Links ]
100. Maes, M., Scharpe, S., Meltzer, H., Okayli, G., Bosmans, E., D'Hondt, P., et al (1994). Increased neopterin and interferon-gamma secretion and lower availability of L- tryptophan in major depression: further evidence for an immune response. Psychiatry Res, 54(2), 143-160. [ Links ]
101. Bonaccorso, S., Lin, H., Verkerk, R., Van Hunsel, F., Libbrecht, I., Scharpé, S., et al (1998). Immune markers in fibromyalgia: comparison with major depressed patients and normal volunteers. J Affect Disord, 48(1), 75-82. [ Links ]
102. Maes, M., Meltzer, H., Buckley, P., & Bosmans, E. (1995). Plasma soluble interleukin-2 and transferrin receptor in schizophrenia and major depression. Eur Arch Psychiatry Clin Neurosci, 244(6), 325-329. [ Links ]
103. Maes, M., Bosmans, E., De Jongh, R., Kenis, G., Vandoolaeghe, E., & Neels, H. (1997). Increased serum IL-6 and IL-1 receptor antagonist concentrations in major depression and treatment resistant depression. Cytokine, 9(11), 853-858. [ Links ]
104. Sluzewska, A., Rybakowski, J., Bosmans, E., Sobieska, M., Berghmans, R., Maes, M., et al (1996). Indicators of immune activation in major depression. Psychiatry Res, 64(3), 161-167. [ Links ]
105. Berk, M., Wadee, A., Kuschke, R., & O’Neill-Kerr A. (1997) Acute phase proteins in major depression. J Psychosom Res. 43(5), 529-534.
106. Song, C., Lin, A., Bonaccorso, S., Heide, C., Verkerk, R., Kenis, G., et al (1998). The inflammatory response system and the availability of plasma tryptophan in patients with primary sleep disorders and major depression. J Affect Disord, 49(3), 211-219. [ Links ]
107. Frommberger, U., Bauer, J., Haselbauer, P., Fräulin, A., Riemann, D., & Berger, M. (1997). Interleukin-6-(IL-6) plasma levels in depression and schizophrenia: comparison between the acute state and after remission. Eur Arch Psychiatry Clin Neurosci, 247(4), 228- 233. [ Links ]
108. Craddock, D., & Thomas, A. (2006). Cytokines and late-life depression. Essent Psychopharmacol, 7(1), 42-52. [ Links ]
109. Thomas, A., Davis, S., Morris, C., Jackson, E., Harrison, R., & O'Brien, J. (2005). Increase in Interleukin-1 in late– life depression. Am J Psychiatry, 162(1), 175-177. [ Links ]
110. Beach, F. (1948). Hormones and behavior, a survey of interrelationships between endocrine secretions and patterns of overt response. New York: Cooper Square Publishers. [ Links ]
111. Gordon, E. (2001) Integrative psychophysiology. Inter J Psychophysiology, 42(2), 95-108. [ Links ]
112. Chrousos, G., & Gold, P. (1998). A healthy body in a healthy mind--and vice versa--the damaging power of "uncontrollable" stress. J Clin Endocrinol Metab, 83(6), 1842-5. [ Links ]
113. Barden, S. (2004). Implication of the hypothalamic–pituitary–adrenal axis in the physiopathology of depression. J Psychiatry Neurosci, 29(3), 185-93. [ Links ]
114. Mynt, A. (2003). Neurochemistry immune systems interaction in depression. PhD Thesis. Maastricht University 2007. [ Links ]
115. Nemeroff, C., Widerlöv, E., Bissette, G., Walléus, H., Karlsson, I., Eklund, K., et al (1984). Elevated concentrations of CSF corticotropinreleasing factor-like immunoreactivity in depressed patients. Science, 226(4680), 1342–1344. [ Links ]
116. Arborelius, L., Owens, J., Plotsky, P., & Nemeroff, C. (1999). The role of corticotropin-releasing factor in depression and anxiety disorders. J Endocrinol, 160(1), 1-12. [ Links ]
117. Board, F., Wadeson, R., & Persky, H. (1957). Depressive affect and endocrine function: blood levels of adrenal cortex and thyroid hormones in patients suffering from depressive reactions. AMA Arch Neurol Psychiatry, 78(6), 612–620. [ Links ]
118. Carroll, J., Curtis, G., Davies, B. Mendels, J., & Sugerman, A. (1976). Urinary free cortisol excretion in depression. Psychol Med, 6(1), 43–50. [ Links ]
119. Carroll, J. (1982). The dexamethasone suppression test for melancholia. Br J Psychiatry 140:292- 304. [ Links ]
120. Mortola, J., Liu, J., & Gillin, C., Rasmussen, D., & Yen, S. (1987). Pulsatile rhythms of adrenocorticotropin (ACTH) and cortisol in women with endogenous depression: evidence for increased ACTH pulse frequency. J Clin Endocrinol Metab, 65(5), 962-8. [ Links ]
121. Sachar, J., Hellman, L., Fukushima, K., Gallagher, T. (1970). Cortisol production in depressive illness: a clinical and biochemical clarification. Arch Gen Psychiatry, 23(4), 289-298. [ Links ]
122. Sachar, J., Hellman, L., Roffwarg, P., Halpern, F., Fukushima, D., & Gallagher, T. (1973). Disrupted 24 hour patterns of cortisol secretion in psychotic depressives. Arch Gen Psychiatry, 28(1), 19–24. [ Links ]
123. Deuschle, M., Schweiger, U., Weber, B., Gotthardt, U., Körner, A., Schmider, J., et al (1997). Diurnal activity and pulsatility of the hypothalamuspituitary adrenal system in male depressed patients and healthy controls. J Clin Endocrinol Metab, 82(1), 234-238. [ Links ]
124. Alesci, S., Martinez, P., Kelkar, S., Ilias, I., Ronsaville, D., Listwak, J., et al (2005). Major depression is associated with significant diurnal elevations in plasma interleukin-6 levels, a shift of its circadian rhythm, and loss of physiological complexity in its secretion: clinical implications. J Clin Endocrinol Metabol, 90(5), 2522-2530. [ Links ]
125. Ehlert, U., Gaab, J., & Heinrichs, M. (2001). Psychoneuroendocrinological contributions to the etiology of depression, posttraumatic stress disorder, and stress-related bodily disorders: the role of the hypothalamus–pituitary– adrenal axis. Biol Psychol, 57(1-3), 141- 152. [ Links ]
126. Parker, K., Schatzberg, A., & Lyons, D. (2003). Neuroendocrine aspects of hypercortisolism in major depression. Horm Behav, 43(1), 60-6. [ Links ]
127. Bos, E., Bouhuys, A., Geerts, E., Van Os, TW., Van der Spoel, I., Brouwer, W., et al (2005). Cognitive, physiological, and personality correlates of recurrence of depression. J Affect Disord, 87(2-3), 221- 229. [ Links ]
128. Niedermeyer, E., & Lopes da Silva, F. (2004). Electroencephalography: basic principles, clinical applications, and related fields. Lippincott Williams & Wilkins. [ Links ]
129. Pascual-Marqui, R., Esslen, M., Kochi, K., & Lehmann, D. (2002). Functional imaging with low resolution brain electromagnetic tomography (LORETA): review, new comparisons, and new validation. Japanese J Clin Neurophysiol, 30:81-94. [ Links ]
130. Penny, W. (2006). En: Friston, K., Ashburner, J., Kiebel, S., Nichols, T., & Penny, W. (Eds.) Statistical Parametric Mapping: The analysis of functional brain images. London: Elsevier. [ Links ]
131. Mulert, C., Jager, L., Schmitt, R., Bussfeld, P., Pogarell, O., Möller, H., et al (2003). Integration of fMRI and simultaneous EEG: towards a comprehensive understanding of localization and time-course of brain activity in target detection. NeuroImage, 22(1), 83–94. [ Links ]
132. Pizzagalli, D., Oakes, T., & Davidson, R. (2003). Coupling of theta activity and glucose metabolism in the human rostral anterior cingulate cortex: An EEG/PET study of normal and depressed subjects. Psychophysiology, 40(6), 939–949. [ Links ]
133. Fallgatter, A., Bartsch, A., & Herrmann, M. (2002). Electrophysiological measurements of anterior cingulate function. J Neural Transm, 109(5-6), 977–988. [ Links ]
134. Koles, Z., Flor-Henry, P., & Lind, J. (2001). Low-resolution electrical tomography of the brain during psychometrically matched verbal and spatial cognitive tasks. Human Brain Mapping, 12(3), 144–156. [ Links ]
135. Saletu, B., Anderer, P., & saletu- Zyhlarz, G. (2006). EEG topography and tomography (LORETA) in the classification and evaluation of the pharmacodynamics of psychotropic drugs. Clin EEG Neurosci, 37(2), 66-80. [ Links ]
136. Veiga, H., Deslandes, A., Cagy, M., Fiszman, A., Piedade, R., & Ribeiro, P. (2003). Neurocortical electrical activity tomography in chronic schizophrenics. Arq Neuropsiquiatr, 61(3B), 712-717. [ Links ]
137. Babiloni, C., Cassetta, E., Binetti, G., Tombini, M., Del Percio, C., Ferreri, F., et al (2007). Resting EEG sources correlate with attentional span in mild cognitive impairment and Alzheimer’s disease. Eur J Neurosci, 25(12), 3742– 3757
138. Pizzagalli, D., Lehmann, D., Hendrick, A., Regard, M., Pascual- Marqui, R., & Davidson, R. (2002). Affective judgments of faces modulate early activity (approximately 160 ms) within the fusiform gyri. Neuroimage, 16(3 pt 1), 663-77. [ Links ]
139. Babiloni, F., Cincotti, F., Babiloni, C., Carducci, F., Mattia, D., Astolfi, L., et al (2005). Estimation of the cortical functional connectivity with the multimodal integration of high-resolution EEG and fMRI data by directed transfer function. NeuroImage, 24(1), 118–131. [ Links ]
140. Horacek, J., Brunovsky, M., Novak, T., Skrdlantova, L., Klirova, M., Bubenikova-Valesova, V. (2007). Effect of low-frequency rTMS on electromagnetic tomography (LORETA) and regional brain metabolism (PET) in schizophrenia patients with auditory hallucinations. Neuropsychobiology, 55(3-4), 132–142. [ Links ]
141. Baumgartner, C. (2004). Controversies in clinical neurophysiology. MEG is superior to EEG in the localization of interictal epileptiform activity. Clin Neurophysiol, 115(5), 1010-20. [ Links ]
142. Davidson, R. (1998). Anterior electrophysiological asymmetries, emotion, and depression: Conceptual and methodological conundrums. Psychophysiology, 35(5), 607–614. [ Links ]
143. Watanabe, E., Nagahori, Y., & Mayanagi, Y. (2002). Focus diagnosis of epilepsy using near-infrared spectroscopy. Epilepsia, 43(9), 50–55. [ Links ]
144. Roche-Labarbe, N., Wallois, F., Ponchel, E., Kongolo, G., & Grebe, R. (2007). Coupled oxygenation oscillation measured by NIRS and intermittent cerebral activation on EEG in premature infants. NeuroImage, 36(3), 718–727. [ Links ]
145. Chandra, P., Salamon, N., Huang, J. Wu, J., Koh, S., Vinters, H., et al (2006). FDG-PET/MRI coregistration and diffusion-tensor imaging distinguish epileptogenic tubers and cortex in patients with tuberous sclerosis complex: a preliminary report. Epilepsia, 47(9), 1543–1549. [ Links ]
146. Le Bihan, D., Mangin, J., Poupon, C., Clark, C., Pappata, S., Molko, N., et al (2001). Diffusion tensor imaging: concepts and applications. J Magn Reson Imaging 13(4), 534–546. [ Links ]
147. Nunez, P. (2000) Toward a quantitive description of large-scale neocortical dynamic function and EEG. Behav Brain Sci, 23(3), 371-98. [ Links ]
148. Hughes, J., & John, E. (1999). Conventional and quantitative electroencephalography in psychiatry. J Neuropsychiatry Clin Neurosci 11(2), 190-208. [ Links ]
149. John, E., Karmel, B., Corning W., Easton, P., Brown, D., et al (1977) Neurometrics. Science, 196(4297), 1393- 410. [ Links ]
150. Davidson, R. (2003). Affective neuroscience and psychophysiology: toward a synthesis. Psychophysiology, 40(5), 655-665. [ Links ]
151. Polich, J. (2004). Clinical application of the P300 event-related brain potential. Phys Med Rehabil Clin N Am, 15(1), 133-161. [ Links ]
152. Cook, I., Leuchter, A., Morgan, M., Witte, E., Stubbeman, W., Abrams, M., et al (2002) Early changes in prefrontal activity characterize clinical responders to antidepressants, Neuropsycho pharmacology, 27(1), 120-31. [ Links ]
153. Hunter, A., Leuchter, A., Morgan, M., Cook, I, (2006) Changes in brain function (quantitative EEG cordance) during placebo lead-in and treatment outcome in clinical trials for major depression. Am J Psychiatry, 163(8), 1426-32. [ Links ]
154. Blackwood, D., Whalley, L., Christie, J., Blackburn, I., St Clair, D., & McInnes, A. (1987). Changes in auditory P3 event-related potential in schizophrenia and depression. Br J Psychiatry, 150(1), 154-160. [ Links ]
155. Urretavizcaya, M., Moreno, I., Benlloch, L., Cardoner, N., Serrallonga, J., Menchón, J., et al (2003) Auditory event-related potentials in 50 melancholic patients: increased N100, N200 and P300 latencies and diminished P300 amplitude. J Affect Disord, 74(3), 293-297. [ Links ]
156. Bruder, G., Towey, J., Stewart, J., Friedman, D., Tenke, C., & Quitkin, F. (1991). Event-related potentials in depression: Influence of task, stimulus hemifield and clinical features on P3 latency. Biol Psychiatry, 30(3), 233–246. [ Links ]
157. Himani, A., Tandon, O., & Bhatia, M. (1999). A study of P300-event related evoked potential in the patients of major depression. Indian J Physiol Pharmacol, 43(3), 367-372. [ Links ]
158. Karaaslan, F., Gonul, A., Oguz, A., Erdinc, E., & Esel, E. (2003). P300 changes in major depressive disorders with and without psychotic features. J Affect Disord, 73(3), 283-7. [ Links ]
159. Schlegel, S., Nieber, D., Herrmann, C., & Bakauski, E, (1991). Latencies of the P300 component of the auditory eventrelated potential in depression are related to the Bech-Rafaelsen Melancholia Scale but not to the Hamilton Rating Scale for Depression. Acta Psych Scand, 83(6), 438-440. [ Links ]
160. Vandoolaeghe, E., van Hunsel, F., Nuyten, D., & Maes, M. (1998). Auditory event related potentials in major depression: Pro-longed P300 latency and increased P200 amplitude. J Affect Disord, 48(2-3), 105-113. [ Links ]
161. Linka, T., Muller, B., Bender, S., & Sartory, G. (2004). The intensity dependence of the auditory evoked N1 component as a predictor of response to Citalopram treatment in patients with major depression. Neurosci Lett, 367(3), 375-378. [ Links ]
162. Mulert, C., Juckel, G., Brunnmeier, M., Karch, S., Leicht, G., Mergl, R., et al (2007). Prediction of treatment response in major depression: integration of concepts. J Affect Disord, 98(3), 215-15. [ Links ]
163. Lee, T., Yu, Y., Chen, T., & Tsai, S. (2005). Loudness dependence of the auditry evoked potential and response to antidepressants in chinese patients with major depression. J Psychiatry Neurosci, 30(3), 202-5. [ Links ]
164. Ruchsow, M., Herrnberger, B., & Wiesend, C., Grön, G., Spitzer, M., & Kiefer, M. (2004). The effect of erroneous responses on response monitoring in patients with major depressive disorder: a study with event-related potentials. Psychophysiology, 41(6), 833-840. [ Links ]
165. Ruchsow, M., Herrnberger, B., Beschoner, P., Grön, G., Spitzer, M., & Kiefer, M. (2006). Error preprocessing in major depressive disorder: evidence from event-related potentials. J Psychiatr Res 40(1), 37-46. [ Links ]
166. Henriques, J., & Davidson, R. (1990). Regional brain electrical asymmetries discriminate between previously depressed subjects and healthy controls. J Abnorm Psychol, 99(1), 22-31. [ Links ]
167. Henriques, J., & Davidson, R. (1991). Left frontal hypoactivation in depression. J Abnorm Psychol 100(4), 535-545. [ Links ]
168. Bruder, G., Fong, R., Tenke, C. Leite, P., Towey, J., Stewart, J., et al (1997). Regional brain asymmetries in major depression with or without an anxiety disorder: A quantitative electroencephalographic study. Biol Psychiatry, 41(9), 939-948. [ Links ]
169. Bruder, G., & Tenke, C. (2005). Electroencephalographic measures of regional hemispheric activity in offspring at risk for depressive disorders. Biol Psychiatry, 57(4), 328-335. [ Links ]
170. Kentgen, L., Tenke, C., Pine, D., Fong, R., Klein, R., & Bruder, G. (2000). Electroencephalographic asymmetries in adolescents with major depression: influence of comorbidity with anxiety disorders. J Abnorm Psychol, 109(4), 797- 802. [ Links ]
171. Coan, J., & Allen, J. (2004). EEG asymmetry as a moderator and mediator of emotion. Biol Psychol, 67(1-2), 7-49. [ Links ]
172. Sutton, S., & Davidson, R. (2000). Prefrontal brain electrical asymmetry predicts the evaluation of affective stimuli. Neuropsychologia, 38(13), 1723– 1733. [ Links ]
173. Kalin, N., Larson, C., Shelton, S., Davidson, R. (1998). Asymmetric frontal brain activity, cortisol, and behavior associated with fearful temperament in Rhesus monkeys. Behav Neurosci, 112(2), 286 - 292. [ Links ]
174. Cacioppo, J. (2004). Feelings and emotions: roles for electrophysiological markers. Biol Psychol, 67(1-2), 235-243. [ Links ]
175. Lubar, J., Congedo, M., & Askew, J. (2003). Low-resolution electromagnetic tomography (LORETA) of cerebral activity in chronic depressive disorder. Inter J Psychophysiol, 49(3), 175-185. [ Links ]
176. Broderick, D. (2005). Neuroimaging in Neuropsychiatry. Psychiatr Clin N Am, 28(3) 549–566. [ Links ]
177. Videbech, P., & Ravnkilde, B. (2004). Hippocampal volume and depression: a meta-analysis of MRI studies. Am J Psychiatry, 161(11), 1957- 1966. [ Links ]
178. Bremner, J. (2005). Changes in Brain Volume in Major Depression. Mind Body, 2(2), 38-46. [ Links ]
179. Sheline, Y. (2000). 3D MRI studies of neuroanatomic changes in unipolar major depression: the role of stress and medical comorbidity. Biol Psychiatry, 48(8), 791-800. [ Links ]
180. Sheline, Y. (2003) Neuroimaging Studies of Mood Disorder Effects on the Brain. Biol Psychiatry, 54(3), 338-352. [ Links ]
181. Drevets, W., Price, J., Simpson, J., Todd, R., Reich, T., Vannier, M., et al (1997). Subgenual prefrontal cortex abnormalities in mood disorders. Nature, 386(6627), 824-827. [ Links ]
182. Coffey, C., Wilkinson, W., Weiner, R., Parashos, I., Djang, W., & Webb, M., et al (1993). Quantitative cerebral anatomy in depression: A controlled magnetic resonance imaging study. Arch Gen Psychiatry, 50(1), 7-16. [ Links ]
183. Rajkowska, G., Miguel-Hidalgo, J., Wei, J., Dilley, G., Pittman, S., Meltzer, H., et al (1999). Morphometric evidence for neuronal and glial prefrontal cell pathology in major depression. Biol Psychiatry, 45(9), 1085-1098. [ Links ]
184. Rajkowska, G. (2000). Postmortem studies in mood disorders indicate altered numbers of neurons and glial cells. Biol Psychiatry, 48(8), 766-777. [ Links ]
185. Ballmaier, M., Toga, A., Blanton, R., Sowell, E., Lavretsky, H., Peterson, J., et al (2004). Anterior cingulate, gyrus rectus, and orbitofrontal abnormalities in elderly depressed patients: an MRI-based parcellation of the prefrontal cortex. Am J Psychiatry, 161(1), 99–108. [ Links ]
186. Soares, J., & Mann, J. (1997). The anatomy of mood disorders&review of structural neuroimaging studies. Biol Psychiatry, 41(9), 86-106. [ Links ]
187. Sheline, Y., Wang, P., Gado, M., Csernansky, J., & Vannier, M. (1996). Hippocampal atrophy in recurrent major depression. Proc Natl Acad Sci USA, 93(9), 3908-3913. [ Links ]
188. Sheline, Y., Sanghavi, M., Mintun, M., & Gado, M. (1999). Depression duration but not age predicts hippocampal volume loss in women with recurrent major depression. J Neurosci, 19(12), 5034-5043. [ Links ]
189. Shah, P., Ebmeier, K., Glabus, M., & Goodwin, G. (1998). Cortical grey matter reductions associated with treatment resistant chronic unipolar depression. Controlled magnetic resonance imaging study. Br J Psychiatry, 172:527-532. [ Links ]
190. MacQueen, G., Campbell, S., McEwen, B., Macdonald, K., Amano, S., Joffe, R., et al (2003) Course of illness, hippocampal function, and hippocampal volume in major depression. PNAS, 100(3), 1387-1392. [ Links ]
191. Pezawas, L., Verchinski, B., Mattay, V., Callicott, J., Kolachana, B., Straub, R., et al (2004). The brain-derived neurotrophic factor val66met polymorphism and variation in human cortical morphology. J Neurosci, 24(45), 10099-10102. [ Links ]
192. Campbell, S., Marriott, M., Nahmias, C., & MacQueen, G. (2004). Lower hippocampal volume in patients suffering from depression: a metaanalysis. Am J Psychiatry, 161(4), 598- 607. [ Links ]
193. Drevets, W. (1998). Functional neuroimaging studies of depression: the anatomy of melancholia. Annu Rev Med, 49:341-61. [ Links ]
194. Gordon, E. (2005). Integrative neuroscience: the role of a standardized database, Clin EEG Neurosci, 36 (2), 64- 75. [ Links ]
195. Drevets, W., Frank, E., Price, J., Kupfer, D., Greer, P., & Mathis, C. (2000). Serotonin type-1A receptor imaging in depression. Nucl Med Biol, 27(5), 499-507. [ Links ]
196. Drevets, W. (2001). Neuroimaging and neuropathological studies of depression: Implications for the cognitiveemotional features of mood disorders. Curr Opin in Neurobiol, 11(2), 240-249. [ Links ]
197. Davidson, R., Abercrombie, H., Nitschke, J., & Putnam, K. (1999). Regional brain function, emotion and disorders of emotion. Curr Opin Neurobiol, 9(2), 228-234. [ Links ]
198. Davidson, R. (2002). Anxiety and affective style: role of prefrontal cortex and amygdala. Biol Psychiatry, 51(1), 68- 80. [ Links ]
199. Abercrombie, H., Schaefer, S., Larson, C., Oakes, T., Lindgren, K., Holden, J., et al (1998). Metabolic rate in the right amygdala predicts negative affect in depressed patients. Neuroreport, 9(14), 3301-3307. [ Links ]
200. Rauch, S., Savage, C., Alpert, N., Fischman, A., & Jenike, M. (1997). The functional neuroanatomy of anxiety: A study of three disorders using positron emission tomography and symptom provocation. Biol Psychiatry, 42(6), 446- 452. [ Links ]
201. Brody, A., Saxena, S., Stoessel, P., Gillies, L., Fairbanks, L., Alborzian, S., et al (2001). Regional brain metabolic changes in patients with major depression treated with either paroxetine or interpersonal therapy: preliminary findings. Arch Gen Psychiatry, 58(7), 631-640. [ Links ]
202. Meyer, J., Ginovart, N., Boovariwala, A., Sagrati, S., Hussey, D., Garcia, A., et al (2006). Elevated monoamine oxidase A levels in the brain: an explanation for the monoamine imbalance of major depression. Arch Gen Psychiatry, 63(11), 1209-1216. [ Links ]
203. Meltzer, C., Price, J., Mathis, C., Butters, M., Ziolko, S., Moses-Kolko, E., et al (2004). Serotonin 1A receptor binding and treatment response in latelife depression. Neuropsychopharmacology, 29(12), 2258-2265. [ Links ]
204. Reivich, M., Amsterdam, J., Brunswick, D., & Shiue, C. (2004). PET brain imaging with [11C] McN5652 shows increased serotonin transporter availability in major depression. J Affect Disord 82(2), 321-327. [ Links ]
205. Sheline, Y., Gado, M., Kraemer, H. (2003). Untreated depression and hippocampal volume loss. Am J Psychiatry, 160(8), 1516-1518. [ Links ]
206. Liotti, M., & Mayberg, H. (2001) Role of functional neuroimaging in the neuropsychology of depression. J Clin Exp Neuropsychol, 23(1), 121-136. [ Links ]
207. Phan, K., Wager, T., Taylor, S., & Liberzon, I. (2002). Functional neuroanatomy of emotion: a metaanalysis of emotion activation studies in PET and fMRI. NeuroImage, 16(2), 331– 348. [ Links ]
208. Parker, G. (2006) Through a glass darkly: the disutility of the DSM nosology of depressive disorders. Can J. Psychiatry. 51(14), 879-86. [ Links ]
209. Gruenberg, A., Goldstein, R., & Pincus, H. (2005) Classification of Depression: Research and Diagnostic Criteria: DSM-IV AND ICD-10. In Licinio, L., & Wong, M. (Eds) Biology of Depression. From novel Insights to Therapeutic Strategies. (Chap 1) WILEY. [ Links ]
210. Luyten, P., & Blatt, S. (2007) Looking back towards the future: is it time to change the DSM approach to psychiatric disorders? The case of depression. Psychiatry. 70(2), 85-99. [ Links ]
211. Alloy, L., & Clements, C. (1998). Hopelessness theory of depression: Tests of the symptom component. Cognit Ther Res, 22(4), 303-335. [ Links ]
212. Abramson, L., Alloy, L., & Hogan, M. (2000). The hopelessness theory of suicidality. En: T. Joiner & M.D. Rudd (Eds.) Suicide Science: Expanding the Boundaries (pp. 127-143). Boston: MA: Kluwer Academic. [ Links ]
213. Hankin, B., Abramson, L., & Siler, M. (2001). A prospective test of the hopelessness theory of depression in adolescence. Cognit Ther Res, 25(5), 607- 632. [ Links ]
214. Beck, T., Steer, R., Kovacs, M., & Garrison, B. (1985). Hopelessness and eventual suicide: A 10 year prospective study of patients hospitalized with suicidal ideation. Am J Psychiatry, 142(5), 559-563. [ Links ]
215. Beck, T., Brown, G., Berchick, J., Stewart, B., & Steer, R. (1990). Relationship between hopelessness and ultimate suicide: A replication with psychiatric patients. Am J Psychiatry, 147(11), 190-195. [ Links ]
216. Nolen-Hoeksema, S., Morrow, J., & Fredrickson, L. (1993). Response styles and the duration of episodes of depressed mood. J Abnorm Psychol, 102(1), 20-28. [ Links ]
217. Nolen-Hoeksema, S. (2000). The role of rumination in depressive disorders and mixed anxiety/depressive symptoms. J Abnorm Psychol, 109(3), 504-511. [ Links ]
218. Just, N., & Alloy, L. (1997). The response styles theory of depression: Tests and an extension of the theory. J Abnorm Psychol, 106(2), 221-229. [ Links ]
219. Spasojevi, J., & Alloy, L. (2001). Rumination as a common mechanism relating depressive risk factors to depression. Emotion, 1(1), 25-37. [ Links ]
220. Klein, D., Durbin, C., & Shankman, S. (2002). Depression and personality. En: Gotlib, I., Hammen, C. (Eds.) Handbook of depression (pp. 115-140). Guilford Press. [ Links ]
221. Ormel, J., Oldehinkel, A., Vollebergh, W. (2004). Vulnerability before, during, and after a major depressive episode: a 3-wave populationbased study. Archives General Psychiatry 61(10), 990-996. [ Links ]
222. Maier, W., Lichtermann, D., Minges, J., & Heun, R., (1992). Personality traits in subjects at risk for unipolar major depression: a family study perspective. J Affect Disord 24(3), 153- 163. [ Links ]
223. Duggan, C., Lee, A., & Murray, R. (1990). Does personality predict longterm outcome in depression?. Br J Psychiatry, 157:19-24. [ Links ]
224. Surtees, P., & Wainwright, N. (1996). Fragile states of mind: neuroticism, vulnerability and the longterm outcome of depression. Br J Psychiatry, 169(3), 338-347. [ Links ]
225. Snaith, P. (1993). Anhedonia: a neglected symptom of psychopathology. Psychol Med, 23(4), 957-966. [ Links ]
226. Keedwell, P., & Andrew, C. (2005) The neural correlates of anhedonia in major depressive disorder. Biol Psychiatry, 58(11), 843–853. [ Links ]
227. Loas, G. (1996) Vulnerability to depression: a model centered on anhedonia. J Affect Disord, 41(1), 39-53. [ Links ]
228. Lemke, M., Puhl, P., Koethe, N., & Winkler, T. (1999). Psychomotor retardation and anhedonia in depression. Acta Psychiatr Scand, 99(4), 252-6. [ Links ]
229. Stein, D. (2008). Depression, anhedonia, and psychomotor symptoms: the role of dopaminergic neurocircuitry. CNS Spectr, 13(7), 561-5. [ Links ]
230. Riemann, D., & Voderholzer, U. (2003). Primary insomnia: a risk factor to develop depression?. J Affect Disord 76(1- 3), 255-9. [ Links ]
231. Vollrath, M., Wicki, W., & Angst, J. (1989). The Zurich study. VIII. Insomnia: association with depression, anxiety, somatic syndromes, and course of insomnia. Eur Arch Psychiatry Neurol Sci, 239(2), 113-24. [ Links ]
232. Fava, M. (2004). Daytime sleepiness and insomnia as correlates of depression. J Clin Psychiatry, 65(16), 27-32. [ Links ]
233. Chang, P., Ford, D., Mead, L., Cooper-Patrick, L., Klag, M. (1997). Insomnia in young men and subsequent depression. Am J Epidemiol, 146(2), 105- 114. [ Links ]
234. Ford, D., & Kamerow, D. (1989). Epidemiologic study of sleep disturbances and psychiatric disorders: an opportunity for prevention?. JAMA, 262(11), 1479-84. [ Links ]
235. Breslau, N., Roth, T., Rosenthal, L., & Andreski, P. (1996). Sleep disturbance and psychiatric disorders: a longitudinal epidemiological study of young adults. Biol Psychiatry, 39(6), 411-18. [ Links ]
236. Hohagen, F., Rink, K., Kappler, C., Schramm, E., Riemann, D., & Weyerer, S. (1993). Prevalence and treatment of insomnia in general practice: a longitudinal study. Eur Arch Psychiatry Clin Neurosci, 242(6), 329-36. [ Links ]
237. Butzlaff, R., & Hooley, J. (1998). Expressed emotion and psychiatric relapse a meta-analysis. Arch Gen Psychiatry, 55(6), 547-552. [ Links ]
238. Mcfarlane, A., Clark, C., Bryant, R., Williams, L., Niaura, R., Paul, R., et al (2005). The impact of early life stress on psychophysiological, personality and behavioral measures in 740 non-clinical subjects. J Int Neurosci, 4(1), 27–40. [ Links ]
239. Hooley, J., Orley, J., & Teasdale, J. (1986). Levels of expressed emotion and relapse in depressed patients. Br J Psychiatry, 148:642-647. [ Links ]
240. Asarnow, J., Tompson, M., Hamilton, E. Goldstein, M., & Guthrie, D. (1994). Family-expressed emotion, childhood-onset depression, and childhood-onset schizophrenia spectrum disorders: is expressed emotion a nonspecific correlate of child psychopathology or a specific risk factor for depression?. J Abnorm Child Psychol, 22(2), 129-46. [ Links ]
241. Schwartz, M., & Wiggins, O. (1987) Diagnosis and ideal types: a contribution to psychiatric classification. Compr Psychiatric, 28(4), 277-91. [ Links ]
242. Florin, I., Nostadt, A., Reck, C., Franzen, U., & Jenkins, M. (1992). Expressed emotion in depressed patients and their partners. Fam Process, 31(2), 163-71. [ Links ]
243. Burt, D., Zembar, M., & Niederehe, G. (1995). Depression and memory impairment: a meta-analysis of the association, its pattern, and specificity. Psychol Bull, 117(2), 285-305. [ Links ]
244. Austin, M., Mitchell, P., & Wilhelm, K., Parker, G., Hickie, I., Brodaty, H. et al (1999). Cognitive function in depression: a distinct pattern of frontal impairment in melancholia?. Psychol Med, 29(1), 73-85. [ Links ]
245. Bremner, J., Vythilingam, M., Vermetten, E., Vaccarino, V., & Charney, D. (2004). Deficits in hippocampal and anterior cingulate function during verbal declarative memory encoding in mid-life depression. Am J Psychiatry, 161(4), 637- 45. [ Links ]
246. Tancer, M., Brown, T., Evans, D., Ekstrom, D., Haggerty, JJ., & Pedersen, C., et al (1990). Impaired effortful cognition in depression. Psychiatry Res, 31(2), 161-168. [ Links ]
247. Liu, S., Chiu, C., Chang, C., Hwang, T., Hwu, G., & Chen, W. (2002). Deficits in sustained attention in schizophrenia and affective disorders: stable versus state-dependent markers. Am J Psychiatry, 159(6), 975-982. [ Links ]
248. Borkowska, A., & Rybakowski, J. (2001). Neuropsychological frontal lobe tests indicate that bipolar depressed patients are more impaired than unipolar. Bipolar Disord, 3(2), 88-94. [ Links ]
249. Hill, S., Keshavan, M. Thase, M., & Sweeney, J. (2004). Neuropsychological dysfunction in antipsychotic-naive firstepisode unipolar psychotic depression. Am J Psychiatr,. 161(6), 996-1003. [ Links ]
250. Sweeney, J., Kmiec, J., & Kupfer, D. (2000). Neuropsychologic impairments in bipolar and unipolar mood disorders on the CANTAB neurocognitive battery. Biol Psychiatry, 48(7), 674-684. [ Links ]
251. Beats, B., Sahakian, B., & Levy, R. (1996). Cognitive performance in tests sensitive to frontal lobe dysfunction in the elderly depressed. Psychol Med, 26(3), 591-603. [ Links ]
252. Fossati, P., Ergis, A., & Allilaire, J. (2002). Executive functioning in unipolar depression: a review. Encephale, 28(2), 97-107. [ Links ]
253. Paradiso, S., Lamberty, G., Garvey, M., & Robinson, R. (1997). Cognitive impairment in the euthymic phase of chronic unipolar depression. J Nerv Ment Dis 185(12), 748-754. [ Links ]
254. Tham, A., Engelbrektson, K., Mathe, A., Johnson, L., Olsson, E., & Aberg-Wistedt, A. (1997). Impaired neuropsychological performance in euthymic patients with recurring mood disorders. J Clin Psychiatry, 58(1), 26-29. [ Links ]
255. Elliott, R. (1996). Neuropsychological impairments in unipolar depression: the influence of perceived failure on subsequent performance. Psychol Med, 26(5), 975- 989. [ Links ]
256. Elliott, R., Sahakian, B., Michael, A., Paykel, S., & Dolan, R. (1998). Abnormal neural response to feedback on planning and guessing tasks in patients with unipolar depression. Psychol Med, 28(3), 559-571. [ Links ]
257. Murphy, F., Rubinsztein, J., Michael, A., Rogers, R., Robbins, T., Paykel, E., et al (2001). Decision making cognition in mania and depression. Psychol Med 31(4), 679-693. [ Links ]
258. Harvey, P., Le Bastard, G., Pochon, J., Levy, R., Allilaire, J., Dubois, B., et al (2004). Executive functions and updating of the contents of working memory in unipolar depression. J Psychiatr Res, 38(6), 567-576. [ Links ]
259. Landro, N., Stiles, T., & Sletvold, H. (2001). Neuropsychological function in nonpsychotic unipolar major depression. Neuropsychiatry Neuropsychol Behav Neurol, 14(4), 233-240. [ Links ]
260. Mikhailova, E., Vladimirova, T., Iznak, A., Tsusulkovskaya, E., & Sushko, N. (1996). Abnormal recognition of facial expression of emotions in depressed patients with major depression disorder and schizotypal personality disorder. Biol Psychiatry, 40(8), 697-705. [ Links ]
261. Surguladze, S., Young, A., Senior, C., Brébion G, Travis, M., & Phillips, M. (2004). Recognition accuracy and response bias to happy and sad facial expressions in patients with major depression. Neuropsychology, 18(2), 212-218. [ Links ]
262. Gur, R., Erwin, R., Gur, E., Zwil, A., Heimberg, C., Kraemer, H. (1992). Facial emotion discrimination: II. behavioral findings in depression. Psychiatry Res, 42(3), 241-251. [ Links ]
263. Kemp, A., Stephan, B., Hopkinson, P., Sumich, A., Paul, R., & Clark, C. (2005). Toward an integrated profile of depression: evidence from the brain resource international database. J Integr Neurosci, 4(1), 95–106. [ Links ]
264. Bouhuys, A., Geerts, E., & Gordijn, M. (1999). Gender-specific mechanisms associated with outcome of depression: perception of emotions, coping and interpersonal functioning. Psychiatry Res, 85(3), 247-261. [ Links ]
265. Bouhuys, A., Geerts, E., & Gordijn, M. (1999b). Depressed patients' perception of facial emotions in depressed and remitted state is associated with relapse: a longitudinal study. J Nerv Ment Dis, 187(10), 595-602. [ Links ]
266. Brain Resource Company, BRC (2008), Comunicación personal en febrero. [ Links ]
267. Rowe, D., Cooper, N., Liddell, B., Clark, C., Gordon, E., & Williams, L. (2007). Brain structures correlates of general and social cognition. J Integr Neurosci, 6(1), 35–74. [ Links ]
268. Williams, L., Simms, E., Clark, C., Paul, R., Rowe, D., & Gordon, E. (2005). The test-retest reliability of a standardized neurocognitive and neurophysiological test battery: “neuromarker”. Intern J Neurosci, 115(12), 1605–1630.
269. Lee, A., Ogle, W., & Sapolsky, M. (2002). Stress and depression: possible links to neuron death in the hippocampus. Bipolar Disord, 4(2), 117- 128. [ Links ]
270. de Kloet, E., Joëls, M., & Holsboer, F. (2005). Stress and the brain: from adaptation to disease. Nat Rev Neurosci 6:463-75. [ Links ]
271. Maroney, D. (2003). Recognizing the potential effect of stress and trauma on premature infants in the NICU: how are outcomes affected?. J Perinatol, 23(8), 679-83. [ Links ]
272. Gibb, B., Alloy, L., Abramson, L., Rose, D., Whitehouse, W., & Hogan, M. (2001). Childhood maltreatment and college students’ current suicidality: A test of the hopelessness theory. Suicide Life Threat Behav, 31(4), 405-15.
273. Gibb, B., Alloy, L., Abramson, L., Rose. D., Whitehouse, W., Donovan P., et al (2001b). History of Childhood Maltreatment, Negative Cognitive Styles and Episodes of Depression in Adulthood. Cognit Ther Res, 25(4), 425-446. [ Links ]
274. Brown, J., Cohen, P., Johnson, J., Smailes, E. (1999). Childhood abuse and neglect: specificity of effects on adolescent and young adult depression and suicidality. J Am Acad Child Adolesc Psychiatry, 38(12), 1490-6. [ Links ]
275. Kaufman, J., & Charney, D. (2001). Effects of early stress on brain structure and function: implications for understanding the relationship between child maltreatment and depression. Dev Psychopathol, 13(3), 451-71. [ Links ]
276. Johnson, J., Cohen, P., Brown, J., Smailes, E., & Bernstein, D. (1999). Childhood maltreatment increases risk for personality disorders during early adulthood. Arch Gen Psychiatry, 56(7), 600-606. [ Links ]
277. Teicher, M., Andersen, S., Polcari, A., Anderson, C., Navalta, C., & Kim, D. (2003). The neurobiological consequences of early stress and childhood Maltreatment. Neurosci and Biobehav Rev, 27(1-2), 33-44. [ Links ]
278. Garber, J., & Flynn, C. (2001). Predictors of depressive cognitions in young adolescents. Cognit Ther Res, 25(4), 353-376. [ Links ]
279. Dweck, C., Davidson, W., & Nelson, S. (1978). Sex differences in learned helplessness: II. The contingencies of evaluative feedback in the classroom and III. An experimental analysis. Dev Psychol, 14(3), 268-276. [ Links ]
280. Brown, G., & Harris, T. (1978). Social Origins of Depression: A Study of Psychiatric Disorder in Women. New York: Free Press. [ Links ]
281. Monroe, S., & Simons, A. (1991). Diathesis-stress theories in the context of life stress research: Implications for the depressive disorders. Psychol Bull 110(3), 406-425. [ Links ]
282. Gotlib, I., & Hammen, L. (1992). Psychological aspects of depression: Toward a cognitive-interpersonal integration. New York: Wiley. [ Links ]
283. O'Hara, M., Schlechte, J., Lewis, D., & Varner, M. (1991) Controlled prospective study of postpartum mood disorders: Psychological, environmental, and hormonal variables. J Abnorm Psychol 100(1), 63-73. [ Links ]
284. Hammen, C., & Brennan, P. (2001). Depressed adolescents of depressed and nondepressed mothers: Tests of an interpersonal impairment hypothesis. J Consult and Clin Psychol 69(2), 284-294. [ Links ]
285. Cumming, M. (1995) Security, emotionality, and parental depression: A commentary. Developmental Psychol, 31(3), 425-427. [ Links ]
286. Asarnow, J., Carlson, G., & Guthrie, D. (1987). Coping strategies, self perception, hopelessness, and perceived family environment in depressed and suicidal children. J Consult Clin Psychol, 55(3), 361-366. [ Links ]
287. Joiner, T., Alfano, M., & Metalsky, G. (1992). When depression breeds contempt: Reassurance seeking, selfesteem, and rejection of depressed college students by their roommates. J Abnorm Psychol, 101(1), 165-172. [ Links ]
288. Lewinsohn, P., Gotlib, I., & Seeley, J. (1997). Depression-related psychosocial variables: Are they specific to depression in adolescents?. J Abnorm Psychol, 106(3), 365-375. [ Links ]
289. Stansfeld, S., Head, J., & Marmot, M. (1998). Explaining social class differences in depression and well-being. Soc Psychiatry Psychiatr Epidemiol, 33(1), 1-9. [ Links ]
290. Griffin, J., Fuhrer, R., Stansfeld, S., & Marmot, M. (2002). The importance of low control at work and home on depression and anxiety: do these effects vary by gender and social class?. Soc Sci Med, 54(5), 783-98. [ Links ]
291. Ritsher, J., Warner, V., Johnson, J., & Dohrenwend, B. (2001). Intergenerational longitudinal study of social class and depression: a test of social causation and social selection models. Br J Psychiatry Suppl, 40;84-90. [ Links ]
292. Okazaki, S. (1997). Sources of ethnic differences between Asian American and white American college students on measures of depression and social anxiety. J Abnorm Psychol 106(1), 52-60. [ Links ]
293. Munford, M. (1994). Relationship of gender, self-esteem, social class, and racial identity to depression in blacks. J Black Psychol, 20(2), 157-174. [ Links ]
294. Aneshensel, C., Clark, V., & Frerichs, R. (1983). Race, ethnicity, and depression: a confirmatory analysis. J Pers Soc Psychol, 44(2), 385-98. [ Links ]
295. Riolo, S., Nguyen, T., Greden, J., & King, C. (2005) Prevalence of depression by race/ethnicity: findings from the National Health and Nutrition Examination Survey III. Am J Public Health 95(6), 998-1000. [ Links ]
296. Nolen - Hoeksema, S. (1991). Responses to depression and their effects on the duration of depressive episodes. J Abnorm Psychol, 100(4), 569-582. [ Links ]
297. Nolen-Hoeksema, S., & Girgus, J. (1994). The emergence of gender differences in depression during adolescence. Psychological Bulletin, 115(3), 424-443. [ Links ]
298. Nolen - Hoeksema, S. (2001). Gender Differences in Depression. Curr Directions in Psychological Science, 10(5), 173-176. [ Links ]
299. Hankin, B., Abramson, L., Moffitt, T., Silva, P., McGee, R., & Angell, K., (1998). Development of depression from preadolescence to young adulthood: emerging gender differences in a 10-year longitudinal study. J Abnorm Psychol, 107(1), 128-140. [ Links ]
300. Allgood-Merten, B., Lewinsohn, P., & Hops, H. (1990). Sex differences and adolescent depression. J Abnorm Psychol, 99(1), 55-63. [ Links ]
301. Kessler, R., McGonagle, K., Swartz, M., Blazer, D., & Nelson, C. (1993) Sex and depression in the national comorbidity survey. I: Lifetime prevalence, chronicity and recurrence. J Affect Disord, 29(2-3), 85-96. [ Links ]
302. Anderson, R., & Freedland, K. (2002). The prevalence of comorbid depression in adults with diabetes. Diabetes Care, 24(6), 1069-1078. [ Links ]
303. Cummings, J., & Masterman, D. (1999). Depression in patients with Parkinson's disease. Int J Geriatr Psychiatry, 14(9), 711-8. [ Links ]
304. Starkstein, S., Preziosi, T., Bolduc, P., & Robinson, R. (1990). Depression in Parkinson's disease. J Nerv Ment Dis, 178(1), 27-31. [ Links ]
305. Hermann, B., Seidenberg, M., & Bell, B. (2000). Psychiatric comorbidity in chronic epilepsy: identification, consequences, and treatment of major depression. Epilepsia, 41(2), 31-41 [ Links ]
306. Black, S. (1999). Increased health burden associated with comorbid depression in older diabetic mexican americans. Results from the hispanic established population for the epidemiologic study of the elderly survey. Diabetes Care, 22(1), 56-64. [ Links ]
307. Knottnerus J, (2002) Evidence base of clinical diagnosis: Evaluation of diagnostic procedures. BMJ, 324(7335), 477-480. [ Links ]
308. Devillé, W., Buntinx, F., Bouter, L., Montori, V., de Vet, H., van der Windt, D., et al (2002). Conducting systematic reviews of diagnostic studies: didactic guidelines. BMC Med Res Methodol, 2(9), 9-23. [ Links ]
309. Harrison, P. (2002). The neuropathology of primary mood disorder. Brain, 125(7), 1428-1449. [ Links ]
310. Thomas, A., O’Brien, J., Davis, S., Ballard, C., Barber, R., Kalaria, R., et al (2002). Ischemic basis for deep white matter hyperintensities in major depression. Arch Gen Psychiatry, 59(9), 785-792.
311. Lloyd, A., Grace, J., Jaros, E., Perry, R., Fairbairn, A., Swann, A., et al (2001). Depression in late life, cognitive decline and white matter pathology in two clinico-pathologically investigated cases. Int J Geriatr Psychiatry 16(3), 281-287. [ Links ]
312. Rajkowska, G., & Miguel-Hidalgo, J. (2007). Gliogenesis and glial pathology in depression. CNS Neurol Disord Drug Targets 6(3), 219-233. [ Links ]
313. Cotter, D., Mackay, D., Chana, G., Beasley, C., Landau, S., & Everall, I. (2002). Reduced neuronal size and glial cell density in area 9 of the dorsolateral prefrontal cortex in subjects with major depressive disorders. Cereb Cortex, 12(4), 386-394. [ Links ]
314. Ongur, D., Drevets, W., & Price, J. (1998). Glial reduction in the subgenual prefrontal cortex in mood disorders. Neurobiol, 95(22), 13290–13295. [ Links ]
315. Banasr, M., Chowdhury, G., Terwilliger, R., Newton, S., Duman, R., Behar, K., et al (2008). Glial pathology in an animal model of depression: reversal of stress-induced cellular, metabolic and behavioral deficits by the glutamatemodulating drug riluzole. Mol Psychiatry, Resumen, revisado en: http://www.ncbi.nlm.nih.gov/pubmed/18 825147. [ Links ]
316. Hamidi, M., Drevets, W., & Price, J. (2004). Glial reduction in amygdala in major depressive disorder is due to oligodendrocytes. Biol Psychiatry, 55(6), 563-9. [ Links ]
317. Páv, M., Ková, H., Fišerova, A., Havrdová, E., & Lisá, V. (2008). Neurobiological Aspects of Depressive Disorder and Antidepressant Treatment: Role of Glia. Physiol Res, 57(2), 151-164.
318. Bowley, M., Drevets, W., Öngür, D., Price, J. (2002). Low glial numbers in the amygdala in major depressive disorder. Biol Psych, 52(5), 404-412. [ Links ]
319. Pittenger, C., Duman, R. (2008) Stress, depression and neuroplasticity: a convergence of mechanisms. Neuropsychopharmacology, 33(1), 88- 109. [ Links ]
320. Mayberg, H. (2003) Modulating dysfunctional limbic-cortical circuits in depression: towards development of brain-based algorithms for diagnosis and optimized treatment. Br Med Bull, 65, 193-207. [ Links ]
321. Leonard, B. (2005) The HPA and immune axes in stress: the involment of the serotonergic system. Eur Psychiatry, Resumen, revisado en http://www.ncbi.nlm.nih.gov/pubmed/16 459240. [ Links ]
Recibido en: 09 Febrero 2009
Revisado en: 23 Marzo 2009
Aceptado en: 07 Abril 2009
AGRADECIMIENTOS
Los autores Agradecen Especialmente a la Lic. Verónica García por su desinteresada revisión ortográfica, lo que hace posible que sea inteligible este trabajo
1 Presidente de la Asociación de Neurociencia Integral Aplicada; Director Gral. de NeuroScopic y Director del Departamento de Investigación y Desarrollo NovoBrain, Monterrey, N.L., Mex. canovo@neuroscopic.com
2 Asistente de investigación de Neuroscopic, Monterrey, N.L., Mexico














