Serviços Personalizados
Journal
artigo
Indicadores
Compartilhar
Cadernos de Pós-Graduação em Distúrbios do Desenvolvimento
versão impressa ISSN 1519-0307versão On-line ISSN 1809-4139
Cad. Pós-Grad. Distúrb. Desenvolv. vol.20 no.2 São Paulo jul./dez. 2020
https://doi.org/10.5935/cadernosdisturbios.v20n2p9-63
Neurotoxicidade do nascimento à puberdade em roedores: revisão dos principais agentes tóxicos e suas implicações
Neurotoxicity from birth to puberty in rodents: review of the main toxic agents and their implications
Neurotoxicidad desde el nacimiento a la pubertad en rodantes: una revisión de los principales agentes tóxicos y sus implicaciones
Julia Zaccarelli-MagalhãesI; Gabriel Ramos de AbreuII; Maria Martha BernardiIII; Helenice de Souza SpinosaIV; Esther Lopes RicciV
IUniversidade de São Paulo (USP), São Paulo, SP, Brasil. E-mail: julia.zaccarelli@usp.br
IIUniversidade de São Paulo (USP), São Paulo, SP, Brasil. E-mail: ramosabreug@usp.br
IIIUniversidade Paulista (Unip), São Paulo, SP, Brasil. E-mail: marthabernardi@gmail.com
IVUniversidade de São Paulo (USP), São Paulo, SP, Brasil. E-mail: hspinosa@usp.br
VUniversidade Presbiteriana Mackenzie (UPM) e Faculdade de Ciências da Saúde Igesp (Fasig), São Paulo, SP, Brasil. E-mail: estherlopesricci@gmail.com
RESUMO
Esta revisão teve como objetivos apresentar os principais parâmetros empregados para a avaliação de neurotoxicidade durante o período inicial da vida de roedores até a puberdade e realizar um levantamento da literatura mais atual dos efeitos tóxicos de praguicidas, medicamentos, drogas lícitas e ilícitas, toxinas e agentes ambientais em filhotes de roedores. No levantamento bibliográfico, feito por meio da base de dados PubMed, empregaram-se os seguintes termos: desenvolvimento pós-natal, toxicidade, roedores e parâmetros físicos e reflexológicos. Os critérios de inclusão foram: 1) língua inglesa; 2) espécies: ratos e camundongos; 3) artigos de revisão e originais; 4) publicações entre 2000 e 2020. Os trabalhos selecionados mostraram quais são os principais parâmetros do desenvolvimento físico e reflexos inatos utilizados para a avaliação de neurotoxicidade, durante o período inicial da vida de um roedor até a puberdade, que podem apontar alterações comportamentais e neurológicas na idade adulta. Os parâmetros de abertura dos olhos e abertura vaginal foram os marcos de desenvolvimento físico mais citados; e os de endireitamento postural em superfície e a geotaxia negativa, os reflexos mais empregados. Os resultados mostraram os diferentes agentes tóxicos capazes de alterar o desenvolvimento de filhotes de roedores, causando danos reversíveis e, em alguns casos, irreversíveis nesses animais. Esses agentes possuem interesse econômico, pois são empregados como praguicidas, medicamentos e drogas lícitas e ilícitas, além de serem toxinas e contaminantes ambientais. Assim, esse levantamento contribui para o uso seguro desses agentes durante o período gestacional e de lactação, períodos cruciais para o desenvolvimento pleno de um ser vivo.
Palavras-chave: Toxicologia do desenvolvimento. Praguicidas. Medicamentos. Toxinas. Contaminantes ambientais.
ABSTRACT
The aim of this review was to present the main parameters used for the assessment of neurotoxicity during the initial period of life of rodents until puberty and to carry out a review of the most current literature on the toxic effects of pesticides, medications, licit and illicit drugs, toxins and environmental agents in rodent offspring. The bibliographic survey was done through the PubMed database; the terms used were postnatal development, toxicity, rodents and physical and reflexological parameters. The filters included were: 1) English language; 2) species: rats and mice; 3) review and original articles; 4) publications between 2000 and 2020. The selected works showed the main parameters of physical development and innate reflexes used for the assessment of neurotoxicity during the initial period of a rodent's life until puberty; these parameters may point out behavioral and neurological changes in adulthood. The eye and vaginal opening were the most cited physical milestones, and the surface righting reflex and negative geotaxis were the most used reflexes. The results showed the different toxic agents capable of altering the development of rodent pups, causing reversible and, in some cases, irreversible damage in these animals. These agents have an economic interest, as they are used as pesticides, medications and legal and illegal drugs, in addition to being toxins and environmental contaminants. Thus, this review contributes to the safe use of these agents during the gestational and lactation period, crucial periods for the correct development of a living being.
Keywords: Developmental toxicology. Pesticides. Medicines. Toxins. Environment contaminant.
RESUMEN
El objetivo de esta revisión fue presentar los principales parámetros utilizados para la evaluación de la neurotoxicidad durante el período inicial de vida de los roedores hasta la pubertad y realizar una encuesta de la literatura más actualizada sobre los efectos tóxicos de los pesticidas, medicamentos, drogas legales e ilegales, toxinas y agentes ambientales en roedores descendientes. En la encuesta bibliográfica, realizada utilizando la base de datos PubMed, los términos utilizados fueron: desarrollo postnatal, toxicidad, roedores y parámetros físicos y reflexológicos. Los criterios de inclusión fueron: 1) idioma inglés; 2) especies: ratas y ratones; 3) revisar artículos y originales; 4) publicaciones entre 2000 y 2020. Los estudios seleccionados mostraron los principales parámetros de desarrollo físico y reflejos innatos utilizados para la evaluación de la neurotoxicidad, durante el período inicial de la vida de un roedor hasta la pubertad, lo que puede señalar cambios conductuales y neurológicos en la edad adulta. Los parámetros de apertura ocular y vaginal fueron los hitos de desarrollo físico más citados, y los de enderezamiento postural de superficie y geotaxis negativa fueron los reflejos más utilizados. Los resultados mostraron los diferentes agentes tóxicos capaces de alterar el desarrollo de las crías de roedores, causando daños reversibles y, en algunos casos, irreversibles en estos animales. Estos agentes tienen un interés económico, ya que se usan como pesticidas, medicamentos y drogas legales e ilegales, además de ser toxinas y contaminantes ambientales. Por lo tanto, esta encuesta contribuye al uso seguro de estos agentes durante el período de gestación y lactancia, períodos cruciales para el desarrollo completo de un ser vivo.
Palabras clave: Toxicología del desarrollo. Pesticidas. Medicamentos. Toxinas. Contaminantes ambientales.
INTRODUÇÃO
A toxicologia é uma ciência multidisciplinar, interdisciplinar e multiprofissional que estuda os efeitos nocivos decorrentes da interação de substâncias químicas e/ou agentes físicos com um organismo biológico (SPINOSA; FUKUSHIMA, 2020).
Uma das grandes áreas da toxicologia é a que se refere ao desenvolvimento. A toxicologia do desenvolvimento estuda os efeitos nocivos causados por agentes tóxicos em um organismo em desenvolvimento, sendo eles anomalias morfológicas (teratologia), retardo no crescimento, alterações funcionais, alterações comportamentais e/ou morte da prole (CAMARGO et al., 2017; GOTARDO; GÓRNIAK, 2020). Esses efeitos podem ser causados pela ação direta do agente tóxico sobre o feto em desenvolvimento ou pela ação indireta, através do organismo materno (BERNARDI; SPINOSA, 2017; CAMARGO et al., 2017).
Em 1977, James Wilson propôs seis princípios básicos da teratologia que são utilizados até hoje na toxicologia do desenvolvimento. São eles: 1) as espécies animais possuem sensibilidades diferentes à exposição a um mesmo agente tóxico; 2) a susceptibilidade de um organismo a um agente tóxico varia de acordo com o estágio de desenvolvimento e o tempo de exposição; 3) os agentes tóxicos atuam de forma específica em células e tecidos; 4) a exposição do feto a um agente tóxico depende de suas propriedades físico-químicas, uma vez que a placenta permite a passagem bidirecional de determinadas substâncias; 5) os diferentes tipos de manifestações de alteração no desenvolvimento estão relacionados com o período do desenvolvimento fetal em que o organismo foi exposto ao agente tóxico; e 6) as manifestações de alteração no desenvolvimento estão relacionadas com a dose de exposição ao agente tóxico (FRIEDMAN, 2010).
Os efeitos tóxicos de uma substância podem ocorrer durante todo o período do desenvolvimento embrionário e fetal de um organismo, contudo o tipo de alteração ocasionado varia de acordo com o período de exposição. Exposições a agentes tóxicos nos períodos de pré-implantação e implantação acarretam embrioletalidade ou completo reparo do dano; esse é um período denominado de efeito "tudo ou nada". Já a exposição a agentes tóxicos no período de organogênese leva a malformações, uma vez que nesse período as estruturas básicas do organismo estão em formação, enquanto durante o período fetal causa anomalias estruturais e funcionais (CAMARGO et al., 2017).
As agências reguladoras internacionais possuem protocolos para a avaliação da toxicidade de agentes no período embrionário e fetal. Destacam-se a Food and Drug Administration (FDA) e a Organisation for Economic Cooperation and Development (OECD), que propõem estudos in vitro ein vivo em animais durante o período pré-acasalamento até o parto. Esses estudos são realizados em pelo menos duas espécies, uma roedora e uma não roedora, com o uso de três doses do agente tóxico a ser avaliado: uma que produz efeito tóxico materno, uma que não promove efeito tóxico e uma intermediária entre elas. A via de administração escolhida para o estudo deve ser a mesma pela qual o indivíduo possa ser exposto ao agente tóxico em condições naturais (UNITED STATES ENVIRONMENTAL PROTECTION AGENCY, 1991; ORGANISATION FOR ECONOMIC COOPERATION AND DEVELOPMENT, 2018).
Atualmente, essas agências vêm incorporando a seus protocolos a avaliação de neurotoxicidade, imunotoxicidade e de desreguladores endócrinos. Assim, em estudos pré-clínicos, as proles são mantidas vivas até a vida adulta para a realização de diferentes testes, uma vez que diversos sistemas não estão completamente desenvolvidos no nascimento (GOTARDO; GÓRNIAK, 2020).
A neurotoxicidade, em particular, refere-se ao dano causado ao sistema nervoso central e/ou periférico por conta da exposição às substâncias tóxicas. A complexidade das funções do sistema nervoso, os eventos neurotóxicos de natureza múltipla e a variabilidade e inacessibilidade dos sítios celulares e moleculares do sistema nervoso são fatores que limitam o estabelecimento de indicadores para se avaliar a ação neurotóxica das substâncias químicas (AMORIM, 2003). Vários indicadores têm sido utilizados para avaliar o risco e a exposição a uma substância neurotóxica, empregando enfoques neurofisiológicos, comportamentais, neuroquímicos, entre outros. A presente revisão teve como objetivos: 1) apresentar os principais parâmetros utilizados para a avaliação de neurotoxicidade durante o período inicial da vida de roedores até a puberdade; e 2) realizar um levantamento da literatura mais atual dos efeitos tóxicos de praguicidas, medicamentos, drogas lícitas e ilícitas, toxinas e agentes ambientais em filhotes de roedores.
MÉTODO
Para a elaboração desta revisão, foi feito levantamento bibliográfico de artigos de revisão e artigos originais por meio da base de dados PubMed. Para a realização da pesquisa, utilizaram-se os seguintes:postnatal development, toxicity, rodent, hair growth, pinna detachment, eruption of incisor teeth, auditive channel opening, eye opening, adult gait, testis descent, balanopreputial separation, vaginal opening, surface righting reflex, palmar grasp reflex, negative geotaxis, cliff avoidance, air righting reflex, auditory startle reflex, vibrissa placing, grip strengthe ascending wire mesh. Adotaram-se como critério de inclusão os seguintes filtros:
• Língua: inglês.
• Espécies: roedores (ratos e camundongos).
• Tipos de artigo: revisões da literatura e artigos originais.
• Período de publicação dos artigos: de 2000 a 2020.
A busca dos artigos foi realizada no período de 30 de março a 6 de abril de 2020 pelo método avançado, no qual foram correlacionados os termos postnatal development, toxicitye rodentcom os termos mencionados anteriormente. A partir de todas as correlações de termos utilizadas, encontraram-se 792 artigos. Utilizaram-se os seguintes critérios de exclusão:
• Artigos duplicados.
• Artigos em outros idiomas.
• Artigos não disponíveis no formato on-line.
• Artigos com metodologia incompleta (não continham dose, via de administração e/ou período de tratamento).
• Artigos sem enfoque no desenvolvimento pós-natal de roedores.
Feita a exclusão, selecionaram-se 162 artigos que foram utilizados na discussão de resultados. Para essa discussão, os artigos foram classificados em cinco grupos de acordo com a toxicidade da substância analisada (praguicidas, medicamentos, drogas lícitas e ilícitas, toxinas e ambiental). Considerou-se também a classificação adotada pelos autores. Alguns artigos estudaram mais de uma substância, de mesma classificação de toxicidade ou não, e, portanto, aparecem mais de uma vez nos tópicos da discussão.
DISCUSSÃO DE RESULTADOS
Desenvolvimento físico
O desenvolvimento físico consiste em uma série de mudanças que ocorrem nos filhotes no período do nascimento ao início da puberdade e que servem de marcos para a maturação fisiológica desses animais (MEEK et al., 2007). A Tabela 1 mostra a descrição dos principais parâmetros utilizados para a avaliação do desenvolvimento físico e o dia pós-natal (DPN) de aparecimento que geralmente ocorrem em ratos e camundongos.
Deve ser destacado que a abertura dos olhos (101/162) e a abertura vaginal (92/162) foram os parâmetros mais utilizados nos trabalhos selecionados, enquanto o andar adulto (7/162) foi o menos empregado.
Parâmetros envolvidos no crescimento corporal
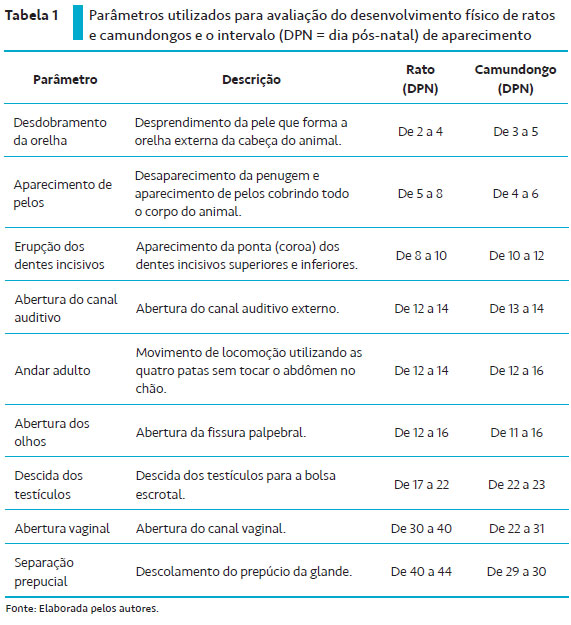
Entre os parâmetros citados na Tabela 1, destacam-se o desdobramento da orelha, o aparecimento de pelos, a erupção dos dentes incisivos, a abertura do canal auditivo e a abertura dos olhos como marcos do crescimento corporal dos roedores (Figura 1). O desenvolvimento desses parâmetros ocorre devido à influência de fatores de crescimento, os quais estão envolvidos em diferentes processos fisiológicos, como crescimento, reparo, diferenciação e desenvolvimento de populações de células específicas (DORCE et al., 2009).
Entre os fatores de crescimento já conhecidos, destaca-se o fator de crescimento epidérmico. Isolado pela primeira vez em 1962 por Cohen, ele foi caracterizado como um polipeptídio promotor da divisão e diferenciação celular dos tecidos epidérmicos. Estudos demonstraram que a administração desse fator de crescimento em ratos, camundongos e hamsters promove a aceleração do desdobramento da orelha, do aparecimento de pelos, da erupção dos dentes incisivos e da abertura dos olhos (HOATH, 1986; SMART et al., 1989; GERENUTTI et al., 2008; SANDINI et al., 2014). Por sua vez, Smart et al. (1989) mostraram que a administração desse fator de crescimento em camundongos recém-nascidos acelera a erupção dos dentes incisivos e a abertura dos olhos, além de atrasar a abertura do canal auditivo e da vagina.
Além do envolvimento dos fatores de crescimento, as alterações no desenvolvimento físico causadas pela exposição a agentes tóxicos também estão relacionadas a alterações no sistema serotoninérgico cerebral (BHARATHI; NATESH; REDDY, 2012). A serotonina possui papel fundamental no desenvolvimento cerebral, pois, além de ser um neurotransmissor, também atua como fator de crescimento, direcionando a proliferação e a maturação de células no cérebro imaturo (KATAKURA et al., 2001).
Dentre todos os parâmetros relacionados com o crescimento corporal, a abertura dos olhos é o parâmetro mais frequente na avaliação do desenvolvimento pós-natal, por ser, além de um marco do crescimento corporal, um sinal externo de maturação do sistema nervoso central em vertebrados e ser extremamente vulnerável à exposição a agentes tóxicos (PODGORAC et al., 2016; ŠEVČÍKOVÁ et al., 2017). O desenvolvimento dos olhos e de suas estruturas anexas (órbita, pálpebras e estruturas nasolacrimais) começa por volta do dia 10 do período embrionário e termina no período pós-natal (POMETLOVÁ et al., 2009).
Além da atuação do fator de crescimento epidérmico, o desenvolvimento dos olhos também depende da atuação dos hormônios tireoidianos para ocorrer (BARKUR; BAIRY, 2016). Esses hormônios estimulam populações celulares específicas, contribuindo para o crescimento dos tecidos oculares, sendo fundamentais para a formação da neurorretina e das estruturas anexas (órbita, pálpebras e estruturas nasolacrimais) (PINAZO-DURÁN et al., 2011; BARKUR; BAIRY, 2016).
Além desses estímulos endócrinos, a abertura dos olhos também está sujeita a alterações por causa dos estímulos ambientais: por exemplo, ambientes enriquecidos podem acelerar a abertura dos olhos, enquanto a separação dos filhotes de suas ninhadas pode atrasar o desenvolvimento desse marco (POMETLOVÁ et al., 2009).
Parâmetros envolvidos na maturação sexual
A descida dos testículos e a separação prepucial em machos, bem como a abertura vaginal em fêmeas, são marcos externos do desenvolvimento sexual em roedores (SINGH et al., 2017). Esses processos são regulados pela ação dos hormônios estrógenos e andrógenos (NASSR et al., 2010; SI et al., 2011; CASTRO; MAIA, 2012; SHEN et al., 2016). Assim, alterações nos níveis hormonais ou na sensibilidade dos tecidos-alvo em momentos críticos podem interferir no desenvolvimento sexual dos animais (WEISENBURGER; HAGLER; TASSINARI, 2004).
A maturação sexual em machos ocorre por causa das interações complexas entre o hipotálamo, a hipófise anterior, os testículos e os órgãos sexuais secundários (NEGRO-VILLAR; OJEDA; MCCANN, 1973; MORAES et al., 2004). O início da puberdade ocorre por conta de alterações sensitivas no eixo hipotálamo-hipófise em razão do feedback negativo dos hormônios andrógenos (SMITH; DAMASSA; DAVIDSON, 1977). Como consequência, ocorre aumento na liberação de gonadotrofina, resultando em aumento na secreção de testosterona pelas células de Leydig, até que um novo estado de equilíbrio seja alcançado (SODERSTEIN; ENEROTH, 1984).
A descida dos testículos é um processo de desenvolvimento obrigatório para promoção da espermatogênese normal dos roedores, que ocorre em duas etapas distintas: 1) fase transabdominal – durante o período de embriogênese, os testículos migram do polo inferior do rim para uma região próxima à bexiga; e 2) fase inguinoscrotal – após o nascimento, os testículos migram da região próxima à bexiga para a bolsa escrotal pelo canal inguinal (HEYNS; HUTSON, 1995; SI et al., 2011; CASTRO; MAIA, 2012). Alterações na descida dos testículos podem ser atribuídas a modificações no desenvolvimento pós-natal do eixo hipotálamo-hipófise-testicular (SUPRIYA; REDDY, 2015).
Outro aspecto importante é o papel exercido pela mãe para a descida dos testículos do filhote. As mães durante a lactação lambem a área genital dos filhotes machos com mais frequência do que a das fêmeas; esse procedimento estimula a liberação de testosterona nos filhotes, hormônio fundamental para a maturação sexual dos machos (ALMEIDA et al., 1996).
Em fêmeas, o único marco externo da puberdade é a canalização da vagina, inicialmente imperfurada, que, por meio da estimulação estrogênica, se torna acessível; a abertura vaginal é, portanto, um processo em que ocorre a apoptose das células epiteliais vaginais desencadeadas pelo aumento da concentração de estradiol (SODERSTEIN; ENEROTH, 1984; MÜLLER et al., 2016). Esse processo ocorre um dia após o primeiro ciclo pré-ovulatório de secreção de gonadotrofinas (SODERSTEIN; ENEROTH, 1984; SANDINI et al., 2014).
A puberdade das fêmeas é regulada pela liberação de hormônio liberador de gonadotrofina (GnRH) por meio do leite materno; esse hormônio inibe a função ovariana dos filhotes, e, à medida que eles crescem e começam a alimentar-se regularmente, a amamentação torna-se menos frequente, levando à redução natural do aporte de GnRH pelo leite materno e permitindo o desenvolvimento ovariano (SODERSTEIN; ENEROTH, 1984).
A puberdade é um período do desenvolvimento em que os animais estão susceptíveis a exposições a agentes ambientais nocivos, como a ação de desreguladores endócrinos. A exposição a compostos de ação estrogênica – como etoxicloro – pode acelerar a abertura vaginal, enquanto a exposição a antiestrógenos – por exemplo, lindano – ou andrógenos – por exemplo, testosterona – pode atrasar a abertura vaginal (OGATA et al., 2001; ROCKETT et al., 2006).
Desenvolvimento reflexológico
Os reflexos são respostas instintivas de um organismo ao ambiente em que ele vive, constituindo respostas específicas, previsíveis e involuntárias a um tipo específico de estímulo (FOX, 1965). A ontogenia dos reflexos é um indicador da adaptação do neonato à vida extrauterina nos estágios iniciais do desenvolvimento (KHALKI et al., 2012; LI et al., 2015). Alterações em sua expressão podem refletir em alterações comportamentais e neurológicas na idade adulta (KHALKI et al., 2012; GALLEGOS et al., 2016). Nesta seção, são discutidos os principais reflexos usados para avaliar o desenvolvimento de filhotes de roedores, bem como os mecanismos que causam essas respostas.
Controle postural
Durante a ontogenia, o desenvolvimento do controle da postura está sujeito a diversos processos neurobiológicos e à percepção do animal sobre o mundo externo, sendo pré-requisito para o desenvolvimento motor (ALTMAN; SUDARSHAN, 1975). Além disso, o controle postural interfere no desenvolvimento cognitivo, bem como no desenvolvimento da comunicação verbal e não verbal (SILVA et al., 1987).
Altman e Sudarshan (1975) destacam em seu trabalho três sistemas periféricos envolvidos na regulação da postura: vestibular, extereoceptivo e proprioceptivo. Além disso, o sistema visual também possui papel importante na aquisição da postura. Os principais reflexos utilizados para avaliar o desenvolvimento do controle postural são: o endireitamento postural (em superfície e aéreo), a geotaxia negativa e o cliff avoidance. Vale ressaltar que os reflexos de endireitamento postural em superfície (83/162) e a geotaxia negativa (70/162) foram os mais empregados nos trabalhos selecionados.
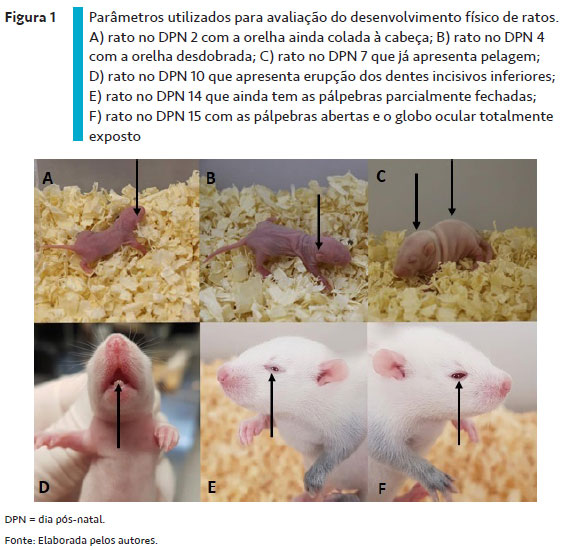
Para a avaliação do endireitamento postural em superfície, os filhotes são colocados sob uma superfície lisa em decúbito dorsal, uma posição corpórea anormal para esses animais, e é observado se eles são capazes de retornar à posição correta, em decúbito ventral, com as quatro patas em contato com a superfície (BEDADA; ENGIDAWORK, 2010; BARKUR; BAIRY, 2016) – Figura 2. Animais recém-nascidos levam mais tempo para retornar à posição correta, e, à medida que vão crescendo, esse tempo diminui gradativamente (PATIN et al., 2004).
O reflexo de endireitamento postural surge logo após o nascimento (entre os DPN 1 e 3) e se estabelece na primeira semana de vida do animal, sendo um indicativo da maturação subcortical, da integridade da função vestibular e cerebelar, bem como da integração da atividade neuromuscular (POMETLOVÁ et al., 2009; SI et al., 2011; BHARATHI; NATESH; REDDY, 2012; CRÉPEAUX et al., 2014; BARKUR; BAIRY, 2016). O atraso no desenvolvimento desse reflexo pode ser sugestivo de atraso no processo de mielinização dos neurônios (DORCE et al., 2009; SANDINI et al., 2014).
Além do tempo necessário para que o animal mude de posição, também é possível analisar a postura do animal durante o processo de endireitamento postural. Podgorac et al. (2016) dividiram a postura desse reflexo em três categorias de progressão sobrepostas: 1) postura em U; 2) postura de saca-rolhas; e 3) endireitamento axial. A postura em U é observada em animais mais jovens, em que o animal faz uma ventroflexão antes de girar a cabeça e o corpo na mesma direção. A postura saca-rolhas é uma forma intermediária do endireitamento postural em que o animal primeiro gira a cabeça e os membros anteriores para uma direção, enquanto gira os membros posteriores para a direção oposta, e, em seguida, gira os membros posteriores para a mesma direção da cabeça e dos membros anteriores. O endireitamento axial é observado em animais adultos, em que o animal corrige sua postura por meio de uma rotação axial cefalocaudal.
Para a observação do reflexo de endireitamento postural aéreo, também denominado reflexo de endireitamento em queda livre, o observador deve suspender os animais a 10 cm de uma almofada, com a parte dorsal voltada para baixo, e soltá-los; os animais devem, então, girar o corpo para cair com a parte ventral do corpo em cima da almofada (DOMMETT; ROSTRON, 2011). A execução desse reflexo está relacionada com os circuitos neuronais vestibulares e visuais, em particular, com as regiões cerebrais do colículo superior, corpo estriado e cerebelo (DIAZ et al., 2014), mas não com o córtex visual (PELLIS et al., 1989).
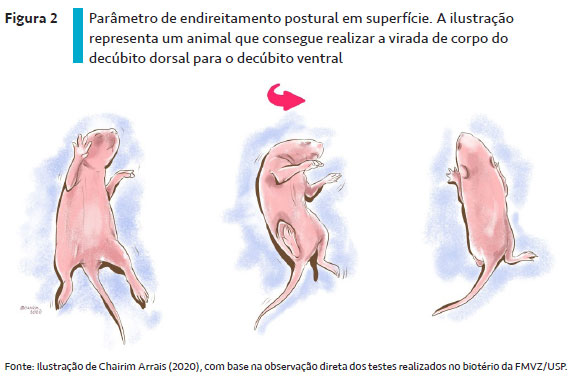
Após a instalação do reflexo de endireitamento postural em superfície, os filhotes passam a desenvolver o reflexo de geotaxia negativa. Para a avaliação desse reflexo, os filhotes são colocados em uma plataforma inclinada, de 30º a 45º, com a cabeça voltada para baixo e é observado se eles são capazes de voltar à posição original, girando o corpo 180º (SUGAWARA et al., 2008; BHARATHI; NATESH; REDDY, 2012; GUMILAR et al., 2015; BARKUR; BAIRY, 2016; MOORE et al., 2019) – Figura 3. Esse reflexo normalmente se instala entre os DPN 6 e 8 e é uma resposta a estímulos gravitacionais envolvida na relação espacial do animal (DORCE et al., 2009).
O reflexo de geotaxia negativa reflete o desenvolvimento do ajuste postural dinâmico (UDO et al., 2014) e, portanto, é muito utilizado como avaliação das funções vestibular e proprioceptiva (DE CASTRO et al., 2007a; ŠEVČÍKOVÁ et al., 2017). Assim, é um indicativo de déficits de desenvolvimento no mecanismo de endireitamento corporal, bem como na coordenação e/ou integração da atividade neuromuscular (BHARATHI; NATESH; REDDY, 2012). Atraso no desenvolvimento desse reflexo sugere alterações na maturação das estruturas cerebrais envolvidas na função motora, em especial do cerebelo (DORCE et al., 2009).
O reflexo de cliff avoidance(reflexo de esquiva do abismo) é outro reflexo relacionado com o controle postural dos roedores. A observação desse reflexo é realizada colocando os filhotes na borda de uma plataforma suspensa, com as patas dianteiras e o focinho acima da borda, e é observado o tempo que o animal leva para se afastar dessa borda; é considerado que o animal adquiriu esse reflexo quando ele realiza a resposta de se afastar da borda em até 5 segundos (BEDADA; ENGIDAWORK, 2010; SI et al., 2011; GUMILAR et al., 2015).
O desenvolvimento do reflexo do cliff avoidance acontece entre os DPN 6 e 10 e é um indicativo do desenvolvimento físico e motor dos animais, refletindo alterações nas funções sensorial e/ou de processamento (PALANZA; PARMIGIANI; VOM SAAL, 2001; SI et al., 2011; GUMILAR et al., 2015; LI et al.,2015). Ele é usado para avaliar a integração do estímulo extereoceptivo (as vibrissas) com a resposta locomotora (retirar o corpo da borda) (ALTMAN; SUDARSHAN, 1975; KAIZAKI et al., 2014). Além disso, esse reflexo também pode ser usado como uma medida de ansiedade, uma vez que animais que apresentam comportamento do tipo ansioso demoram mais para retirar o corpo da borda; esse reflexo é, portanto, útil na avaliação de medicamentos para redução de ansiedade (PALANZA; PARMIGIANI; VOM SAAL, 2001; SI et al., 2011).
Respostas motoras
A preensão palmar é um reflexo motor primitivo que envolve a maturação dos sistemas nervosos central e periférico (SANDINI et al., 2014). A observação desse reflexo é feita com o auxílio de um objeto fino, como um clipe, com o qual o observador toca o coxim plantar do animal e observa se o filhote fecha a pata em resposta ao contato físico (UDO et al., 2014) – Figura 4. Os filhotes de roedores nascem com esse reflexo e ele deve desaparecer à medida que o animal se desenvolve, geralmente entre os DPN 8 e 10 (DORCE et al., 2009). Esse reflexo é equivalente ao reflexo de Babinski em seres humanos (ALDER; ZBINDEN, 1977) e, quando persiste mais tardiamente, pode indicar a presença de lesão neurológica (KAKITANI et al., 2010).
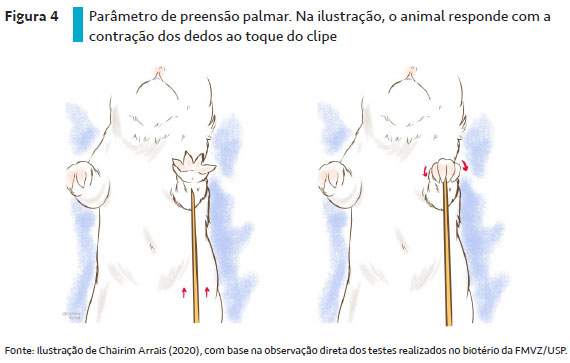
Força muscular
Os reflexos mais utilizados para medir a força muscular em roedores são a força de agarrar e o ascending wire mesh (subir em uma grade de metal inclinada) (BOUAYED et al., 2009). A força de agarrar normalmente se instala entre o DPN 10 e o DPN 16 e pode ser avaliada de duas formas: suspensão na barra ou utilizando o aparato de medição de tensão (BOWEN; HANNIGAN, 2013).
Para a avaliação por suspensão na barra, os filhotes são suspensos segurando uma haste de metal com as patas dianteiras, sendo observado o tempo que os animais permanecem pendurados (SUGAWARA et al., 2008; BOWEN; HANNIGAN, 2013; CRÉPEAUX et al., 2014; BRYS; PUPE; BIZARRO, 2014). Já para o método utilizando o aparato de medição de tensão, os filhotes são segurados pela base da cauda e as patas dianteiras são posicionadas na barra móvel do aparato; em seguida, os animais são puxados pela cauda e é mensurada a força máxima de agarrar no ponto em que o animal solta a barra (BOWEN; HANNIGAN, 2013).
Atraso no desenvolvimento no reflexo de força de agarrar é indicativo de prejuízo no desenvolvimento de força muscular e do reflexo de suspensão (BRYS; PUPE; BIZARRO, 2014). Déficits no desenvolvimento desses reflexos também podem estar relacionados com alterações no peso corpóreo materno e no consumo de ração durante os períodos gestacional e de lactação (COLOMINA et al., 2005).
Para a avaliação do reflexo de ascending wire mesh, é utilizada uma malha de arame (50 x 30 cm) de modo que metade da malha fique imersa em água a 26º C e metade fique fora da superfície; os filhotes são posicionados em cima da malha com apenas a cauda em contato com a água, sendo observado o dia do desenvolvimento em que o filhote consegue alcançar o topo da malha de arame (BARKUR; BAIRY, 2016). Esse reflexo se instala entre o DPN 14 e o DPN 18 (BHARATHI; NATESH; REDDY, 2012).
O reflexo de ascending wire meshavalia o desenvolvimento de habilidades motoras complexas e é indicativo de déficits motores sutis (ALTMAN; SUDARSHAN, 1975; BARKUR; BAIRY, 2016), estando relacionado com funções locomotoras cerebelares (NAM et al., 2019). O cerebelo é responsável por receber informações e nível inconsciente e coordenar atividades de função motora e sensitiva, como o domínio dos músculos, da visão, do tato e da audição; déficits nessa área podem se manifestar como ataxia (D'ANGELO, 2018).
Sistema auditivo
O reflexo de sobressalto avalia o desenvolvimento do sistema auditivo de roedores. Para a observação desse reflexo, o observador faz um estalido alto com os dedos a aproximadamente 10 cm de distância da cabeça do animal e deve observar se o filhote manifesta o comportamento de sobressalto de corpo inteiro em resposta ao estalido (Figura 5); o desenvolvimento desse reflexo ocorre entre os DPN 10 e 15 (SANDINI et al., 2014).
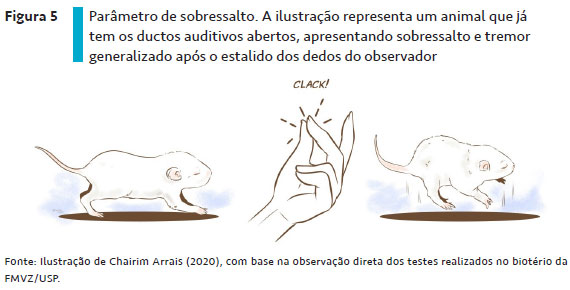
Esse reflexo ocorre em paralelo com a abertura do ducto auditivo, sendo o início do processo de percepção de sons do ambiente (ALTMAN; SUDARSHAN, 1975). Ele é uma resposta à estimulação do complexo do núcleo coclear e à ativação do sistema trigêmeos e/ou vestibular (SANDINI et al., 2014).
Vibrissa placing
O vibrissa placing (estímulo da vibrissa) é um reflexo comportamental sensorial de orientação que está relacionado, entre outros, com a captação de movimento e com a busca pelo alimento (PATIN et al., 2004). Para a observação desse reflexo, o observador deve segurar o filhote pela cauda e tocar suas vibrissas com um objeto fino, como um clipe. Ao ser tocado, o animal deve levantar a cabeça e estender os membros anteriores com o objetivo de agarrar o objeto. O desenvolvimento desse reflexo se dá entre os DPN 6 e 10 (CHEHIMI et al., 2012). Esse reflexo foi o menos empregado nos trabalhos selecionados no presente estudo (2/162).
Toxicidade de praguicidas
O termo praguicida se refere a uma substância química, de origem natural ou sintética, utilizada para matar, repelir ou mitigar organismos que causam lesão ou que transmitem doenças para plantas e animais (SPINOSA; FUKUSHIMA, 2020). Esses compostos podem ser classificados de diversas formas, mas, do ponto de vista toxicológico, a melhor forma de classificação é por meio da finalidade de sua utilização associada à estrutura química do composto. Assim, há as seguintes classes de praguicidas: inseticidas, herbicidas, fungicidas, acaricidas e raticidas (SPINOSA, 2020).
Dentre os 162 trabalhos analisados nesta revisão, 25 apresentam os efeitos do tratamento com praguicidas no desenvolvimento de filhotes de ratos e camundongos (Quadro 1). Os principais praguicidas estudados nesses trabalhos foram a atrazina (4/25), os organoclorados (4/25), a cipermetrina (2/25), o cloreto de trifenilestanho (2/25), o fipronil (2/25), o glifosato (2/25) e os organofosforados (2/25). A maioria dos trabalhos utilizou o rato como mode-lo animal (22/25) e a exposição ao praguicida foi feita durante os períodos de gestação e lactação (14/25). Os parâmetros físicos mais afetados foram abertura vaginal (8/25), abertura dos olhos (4/25), descida dos testículos (4/25) e separação prepucial (4/25). Os reflexos mais afetados foram endireitamento postural em superfície (3/25), geotaxia negativa (3/25), cliff avoidance(2/25) e força de agarrar (2/25).
Toxicidade de medicamentos
Medicamento é um produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico. Os principais grupos de medicamentos de importância para a toxicologia são: analgésicos, anti-inflamatórios não esteroides, medicamentos com ação no sistema nervoso central e antineoplásicos (SALLES-GOMES; GARCIA; SPINOSA, 2020).
De todos os trabalhos selecionados para esta revisão, 31 avaliaram as implicações do tratamento com medicamentos no desenvolvimento de filhotes ratos e camundongos (Quadro 2). Os principais grupos de medicamentos estudados nesses trabalhos foram: repositores hormonais – dietilestilbestrol e estradiol (10/31); fitoterápicos – astragaloside IV, linhaça, Passiflora incarnata, Pippaliyadi yoga e sapthaparna (5/31); antimicrobianos – etambutol, fluorquinolona, isoniazida, rifampicina e triclosana (3/31); e anticonvulsivantes – ácido valproico e carbamazepina (2/31). A maior parte dos trabalhos utilizou
o rato como modelo animal (27/31) e fez a exposição ao medicamento durante os períodos de gestação e lactação (19/31). Os parâmetros físicos mais afetados foram abertura vaginal (8/31), abertura dos olhos (4/31), descida dos testículos (4/31) e separação prepucial (4/31), enquanto os parâmetros reflexológicos mais afetados foram endireitamento postural em superfície (6/31), geotaxia negativa (5/31) e ascending wire mesh (3/31).
Toxicidade de drogas lícitas e ilícitas
Drogas, na acepção atual, são substâncias químicas que levam a alterações de humor e de comportamento, e que causam disfunções no sistema nervoso central; geralmente são substâncias químicas que levam à tolerância e à dependência (SPINOSA; FUKUSHIMA, 2020). Dentre os trabalhos analisados nesta revisão, 13 avaliaram os efeitos da exposição a drogas lícitas e ilícitas no desenvolvimento de filhotes (Quadro 3). As drogas estudadas nesses trabalhos foram metanfetamina (6/13), álcool (4/13), nicotina (2/13) e cafeína (1/13). O rato foi o modelo animal de escolha em grande parte dos trabalhos (10/13), bem como a gestação foi o período de exposição utilizado em grande parte dos trabalhos (6/13). Os parâmetros físicos mais afetados foram abertura dos olhos (7/13), aparecimento dos pelos (3/13) e erupção dos dentes incisivos (3/13). Os parâmetros reflexológicos mais afetados foram endireitamento postural em superfície (10/13), geotaxia negativa (6/13) e cliff avoidance(4/13).
Toxicidade por toxinas
Toxinas são substâncias tóxicas produzidas por seres vivos, podendo ser classificadas em: 1) toxinas bacterianas – são aquelas produzidas por bactérias; 2) micotoxinas – são aquelas produzidas por fungos; 3) fitotoxinas – são aquelas produzidas por plantas; e 4) zootoxinas – são aquelas produzidas por animais e podem ser classificadas em peçonhas (substância tóxica transmitida a outro animal por meio de um órgão inoculador) e veneno (substância tóxica presente num animal que não possui órgão inocular, podendo atingir outro animal quando tocado, mordido) (SPINOSA; FUKUSHIMA, 2020).
Dos 162 trabalhos selecionados nesta revisão, 11 analisaram os efeitos da exposição a toxinas no desenvolvimento de filhotes (Quadro 4). Esses trabalhos trazem informações sobre os efeitos de toxinas de todos os grupos de classificação: 1) toxinas bacterianas – microcystin-LR; 2) micotoxinas – aflatoxina B1, rubratoxina B e zearalenona; 3) fitotoxinas – Catha edulis, Ipomoea carnea e picrotoxina; e 4) zootoxinas – N-óxido de trimetilamina e Tityus bahiensis. A maior parte dos trabalhos utilizou o rato como modelo animal (8/11) e a gestação como período de exposição a essas toxinas (6/11). Os parâmetros físicos mais afetados foram abertura vaginal (4/11) e abertura dos olhos (3/11), enquanto os parâmetros reflexológicos foram geotaxia negativa (6/11), cliff avoidance (6/11) e endireitamento postural em superfície (4/11).
Toxicidade ambiental
A toxicologia ambiental estuda os efeitos nocivos da exposição de organismos vivos aos agentes tóxicos presentes na água, no solo e no ar (SPINOSA; FUKUSHIMA, 2020). Dentre os artigos selecionados, 85 estudos apresentam as implicações no desenvolvimento de filhotes da exposição aos agentes tóxicos ambientais (Quadro 5). Os principais agentes estudados nesses trabalhos foram ácidos perfluoroalquílicos (12/85), bisfenol A (8/85), mercúrio (8/85) e PCB (8/85). Novamente o rato foi o modelo escolhido pela maioria dos trabalhos (57/85) e os períodos de exposição aos agentes tóxicos foram durante a gestação e a lactação (49/85). Os parâmetros físicos mais afetados foram abertura vaginal (27/85), abertura dos olhos (20/85), separação prepucial (8/85) e erupção dos dentes incisivos (7/85). Os reflexos mais afetados foram geotaxia negativa (21/85), endireitamento postural em superfície (17/85) e força de agarrar (14/85).
CONCLUSÕES
Na presente revisão, os trabalhos selecionados mostraram quais são os principais parâmetros utilizados para a avaliação de neurotoxicidade durante o período inicial da vida de um roedor até a puberdade. Esses parâmetros se referem a marcos do desenvolvimento físico desses animais e a reflexos inatos que podem apontar alterações comportamentais e neurológicas em diferentes regiões dos sistemas nervosos central e periférico do organismo em desenvolvimento. Os parâmetros de abertura dos olhos e abertura vaginal foram os marcos de desenvolvimento físico mais utilizados nos trabalhos analisados, enquanto o endireitamento postural em superfície e a geotaxia negativa foram os reflexos mais empregados.
Além disso, os trabalhos mostraram os diferentes agentes tóxicos capazes de alterar o desenvolvimento de filhotes de roedores, causando danos reversíveis e, em alguns casos, irreversíveis nesses animais. Esses agentes possuem interesse econômico, uma vez que são utilizados como praguicidas, medicamentos e drogas lícitas e ilícitas, além das toxinas e contaminantes ambientais. A presente revisão enfatizou a importância do modelo animal que emprega os roedores para o estudo da neurotoxicidade e, assim, contribuiu para o entendimento do mecanismo de ação das diferentes substâncias químicas e o uso/ exposição seguros destas durante o período perinatal, período crucial para o desenvolvimento pleno de um animal.
REFERÊNCIAS
ABBOTT, B. D. et al. Perfluorooctanoic Acid – induced developmental toxicity in the mouse is dependent on expression of peroxisome proliferator – activated receptor-alpha. Toxicological Sciences, v. 98, n. 2, p. 571-581, 2007. DOI: 10.1093/toxsci/ kfm110 [ Links ]
ABU-TAWEEL, G. M.; AJAREM, J. S.; AHMAD, M. Neurobehavioral toxic effects of perinatal oral exposure to aluminum on the developmental motor reflexes, learning, memory and brain neurotransmitters of mice offspring. Pharmacology, Biochemistry and Behavior, v. 101, n. 1, p. 49-56, 2012. DOI: 10.1016/j.pbb.2011.11.003 [ Links ]
AJAREM, J. S. et al. Camellia sinensis prevents perinatal nicotine-induced neurobehavioral alterations, tissue injury, and oxidative stress in male and female mice newborns. Oxidative Medicine and Cellular Longevity, v. 2017, p. 1-16, 2017. DOI: 10.1155/ 2017/5985219 [ Links ]
ALDER, S.; ZBINDEN, G. Methods for the evaluation of physical, neuromuscular and behavior development of rats in early postnatal life. In: NEUBERT, D.; MERKER, H. J.; KWAIGROCH, T. E. Evaluation of embriotoxic effects in animals. Stuttgard: Georg Thieme, 1977. p. 175-185. [ Links ]
ALMEIDA, R. G. et al. Perinatal astemizole exposure in the rat throughout gestation: long-term behavioral and anatomic effects associated with reproduction. Comparative Biochemistry and Physiology, v. 114, n. 2, p. 123-127, 1996. DOI: 10.1016/07428413(96)00013-8 [ Links ]
ALTMAN, J.; SUDARSHAN, K. Postnatal development of locomotion in the laboratory rat. Animal Behaviour, v. 23, n. 4, p. 896-920, 1975. DOI: 10.1016/00033472(75)90114-1 [ Links ]
AMORIM, L. C. A. Os biomarcadores e sua aplicação na avaliação da exposição aos agentes químicos ambientais. Revista Brasileira de Epidemiologia, v. 6, n. 2, p. 158-170, 2003. DOI: 10.1590/S1415-790X2003000200009 [ Links ]
ANDRETTA, R. R. et al. Carbamazepine-exposure during gestation and lactation affectspubertal onset and spermatic parameters in male pubertal offspring. Reproductive Toxicology, v. 44, p. 52-62, 2014. DOI: 10.1016/j.reprotox.2013.09.009 [ Links ]
ASO, S. et al. A two-generation reproductive toxicity study of 4-nitrotoluene in rats. The Journal of Toxicological Sciences, v. 30, p. 117-134, 2005. DOI: 10.2131/jts.30.s117 [ Links ]
BACCHI, A. D. et al. Developmental exposure to Passiflora incarnata induces behavioural alterations in the male progeny. Reproduction, Fertility and Development, v. 25, n. 5, p. 782-789, 2013. DOI: 10.1071/RD11307 [ Links ]
BALASINOR, N. et al. Postnatal development and reproductive performance of F1 progeny exposed in utero to an ayurvedic contraceptive: Pippaliyadi yoga. Journal of Ethnopharmacology, v. 109, n. 3, p. 406-411, 2007. DOI: 10.1016/j.jep.2006.08.007 [ Links ]
BARKUR, R. R.; BAIRY, L. K. Comparison of the developmental milestones and preweaning neurobehavioral parameters in rat pups exposed to lead (Pb) during gestation, lactation and pregestation period. Drug and Chemical Toxicology, v. 39, n. 3, p. 248-255, 2016. DOI: 10.3109/01480545.2015.1082136 [ Links ]
BARROS, A. L. et al. In utero and lactational exposure to fipronil in female rats: Pregnancy outcomes and sexual development. Journal of Toxicology and Environmental Health, v. 79, n. 6, p. 266-273, 2016. DOI: 10.1080/15287394.2016.1149132 [ Links ]
BASO, A. C. Z. et al. Effects of maternal exposure to picrotoxin during lactation on physical and reflex development, square crossing and sexual behavior of rat offspring. Pharmacology, Biochemistry and Behavior, v. 75, n. 4, p. 733-740, 2003. DOI: 10.1016/ s0091-3057(03)00146-1 [ Links ]
BEDADA, W.; ENGIDAWORK, E. The neuropsychopharmacological effects of catha edulis in mice offspring born to mothers exposed during pregnancy and lactation. Phytotherapy Research, v. 24, n. 2, p. 268-276, 2010. DOI: 10.1002/ptr.2925 [ Links ]
BERNARDI, M. M.; SPINOSA, H. S. Exposição aos medicamentos durante o período perinatal. In: SPINOSA, H. S.; GÓRNIAK, S. L.; BERNARDI, M. M. Farmacologia aplicada à medicina veterinária. Rio de Janeiro: Guanabara Koogan, 2017. p. 900-908. [ Links ]
BEYROUTY, P.; CHAN, H. M. Co-consumption of selenium and vitamin E altered the reproductive and developmental toxicity of methylmercury in rats. Neurotoxicology and Teratology, v. 28, n. 1, p. 49-58, 2006. DOI: 10.1016/j.ntt.2005.11.002 [ Links ]
BHARATHI, K. N.; NATESH, T. S.; REDDY, A. A. Prenatal exposure to anti tubercular drugs and postnatal effect on growth, development and cognitive ability in rats. Progress in Neuro-Psychopharmacology & Biological Psychiatry, v. 37, n. 1, p. 203-209, 2012. DOI: 10.1016/j.pnpbp.2012.01.004 [ Links ]
BLACK, P. et al. Modulation of the effects of methylmercury on rat neurodevelopment by co-exposure with Labrador Tea (Rhododendron tomentosum ssp. subarcticum). Food and Chemical Toxicology, v. 49, n. 9, p. 2336-2342, 2011. DOI: 10.1016/j.fct.2011.06.035 [ Links ]
BOUAYED, J. et al. Effects of lactational exposure to benzo[α]pyrene (B[α]P) on postnatal neurodevelopment, neuronal receptor gene expression and behaviour in mice. Toxicology, v. 259, n. 3, p. 97-106, 2009. DOI: 10.1016/j.tox.2009.02.010 [ Links ]
BOWEN, S. E.; HANNIGAN, J. H. Binge toluene exposure in pregnancy and pre-weaning developmental consequences in rats. Neurotoxicology and Teratology, v. 38, p. 29-35, 2013. DOI: 10.1016/j.ntt.2013.04.002 [ Links ]
BOWEN, S. E. et al. Abuse pattern of gestational toluene exposure and early postnatal development in rats. Neurotoxicology and Teratology, v. 27, n. 1, p. 105-116, 2005. DOI: 10.1016/j.ntt.2004.09.007 [ Links ]
BOWERS, W. J. et al. Early developmental neurotoxicity of a pcb/organochlorine mixture in rodents after gestational and lactational exposure. Toxicological Sciences, v. 7, n. 1, p. 51-62, 2004. DOI: 10.1093/toxsci/kfg248 [ Links ]
BRANCHI, I.; ALLEVA, E.; COSTA, L. G. Effects of perinatal exposure to a polybrominated diphenyl ether (PBDE 99) on mouse neurobehavioural development. NeuroToxicology, v. 23, n. 3, p. 375-384, 2002. DOI: 10.1016/S0161-813X(02)00078-5 [ Links ]
BROWN, N. M. et al. Impact of perinatal exposure to equol enantiomers on reproductive development in rodents. Reproductive Toxicology, v. 32, n. 1, p. 33-42, 2011. DOI: 10.1016/j.reprotox.2011.05.008 [ Links ]
BRYS, I.; PUPE, S.; BIZARRO, L. Attention, locomotor activity and developmental milestones in ratsprenatally exposed to ethanol. International Journal of Developmental Neuroscience, v. 38, p. 161-168, 2014. DOI: 10.1016/j.ijdevneu.2014.08.007 [ Links ]
CADA, A. M.; GRAY, E. P.; FERGUSON, S. A. Minimal behavioral effects from developmental cerebellar stunting in young rats induced by postnatal treatment with α-difluoromethylornithine. Neurotoxicology and Teratology, v. 22, n. 3, p. 415-420, 2000. DOI: 10.1016/s0892-0362(99)00085-9 [ Links ]
CAMARGO, E. L. A. et al. Comportamento materno: uma revisão da inter-relação com a toxicologia do desenvolvimento em roedores. Cadernos de Pós-Graduação em Distúrbios do Desenvolvimento, v. 17, n. 1, p. 8-25, 2017. DOI: 10.5935/cadernosdisturbios. v17n1p8-25 [ Links ]
CASTRO, V. L. S. S.; MAIA, A. H. Prenatal epoxiconazole exposure effects on rat postnatal development. Birth Defects Research (Part B), v. 95, n. 2, p. 123-129, 2012. DOI: 10.1002/bdrb.20345 [ Links ]
CECCATELLI, R. et al. Gene expression and estrogen sensitivity in rat uterus after developmental exposure to the polybrominated diphenylether PBDE 99 and PCB. Toxicology, v. 220, n. 2-3, p. 104-116, 2006. DOI: 10.1016/j.tox.2005.12.004 [ Links ]
CHANG, S. et al. Reproductive and developmental toxicity of potassiumperfluorohexanesulfonate in CD-1 mice. Reproductive Toxicology, v. 78, p. 150-168, 2018. DOI: 10.1016/j.reprotox.2018.04.007 [ Links ]
CHEHIMI, L. et al. Chronic exposure to mercuric chloride during gestation affects sensorimotor development and later behaviour in rats. Behavioural Brain Research,v. 234, n. 1, p. 43-50, 2012. DOI: 10.1016/j.bbr.2012.06.005 [ Links ]
CHENG, J.; FUJIMURA, M.; BO, D. Assessing pre/post-weaning neurobehavioral development for perinatal exposure to low doses of methylmercury. Journal of Environmental Science, v. 38, p. 36-41, 2015. DOI: 10.1016/j.jes.2015.05.027 [ Links ]
CHENG, J. et al. Neurobehavioural effects, redox responses and tissue distribution in rat offspring developmental exposure to BDE-99. Chemosphere, v. 75, n. 7, p. 963-968, 2009. DOI: 10.1016/j.chemosphere.2009.01.004 [ Links ]
CHENG, J. et al. Neurobehavioral effects, c-Fos/Jun expression and tissue distribution in rat offspring prenatally co-exposed to MeHg and PFOA: PFOA impairs Hg retention. Chemosphere, v. 91, n. 6, p. 758-764, 2013. DOI: 10.1016/j.chemosphere.2013.02.016 [ Links ]
COHEN, S. Isolation of a mouse submaxillary gland protein accelerating incisor eruption and eyelid opening in the new-born animal. Journal of Biological Chemistry, v. 237, p. 1555-1562, 1962. [ Links ]
COLOMINA, M. T. et al. Concurrent exposure to aluminum and stress during pregnancy in rats: effects on postnatal development and behavior of the offspring. Neurotoxicology and Teratology, v. 27, n. 4, p. 565-574, 2005. DOI: 10.1016/j.ntt.2005.06.014. [ Links ]
CRÉPEAUX, G. et al. Short-term effects of a perinatal exposure to a 16 polycyclic aromatic hydrocarbon mixture in rats: assessment of early motor and sensorial development and cerebral cytochrome oxidase activity in pups. Neurotoxicology, v. 43, p. 90-101, 2014. DOI: 10.1016/j.neuro.2014.03.012 [ Links ]
CROFTON, K. M. et al. PCBs, thyroid hormones, and ontotoxicity in rats: cross-fostering experiments demonstrate the impact of postnatal lactation exposure. Toxicological Science, v. 57, n. 1, p. 131-140, 2000. DOI: 10.1093/toxsci/57.1.131 [ Links ]
DALLEGRAVE, E. et al. Pre and postnatal toxicity of the commercial glyphosate formulation in Wistar rats. Archives of Toxicology, v. 81, n. 9, p. 665–673, 2007. DOI: 10.1007/s00204-006-0170-5 [ Links ]
DALSENTER, P. R. et al. Pre and postnatal exposure to endosulfan in Wistar rats. Human & Experimental Toxicology, v. 22, n. 4, p. 171-175, 2003. DOI: 10.1191/ 0960327103ht351oa [ Links ]
D'ANGELO, E. Physiology of the cerebellum. Handbook of Clinical Neurology, v. 154, p. 85-108, 2018. DOI: 10.1016/B978-0-444-63956-1.00006-0 [ Links ]
DAS, K. P. et al. Effects of perfluorobutyrate exposure during pregnancy in the mouse. Toxicological Sciences, v. 105, n. 1, p. 173-181, 2008. DOI: 10.1093/toxsci/kfn099 [ Links ]
DAS, K. P. et al. Developmental toxicity of perfluorononanoic acid in mice. Reproductive Toxicology, v. 51, p. 133-144, 2015. DOI: 10.1016/j.reprotox.2014.12.012 [ Links ]
DAVIS, L. K. et al. The effects of prenatal exposure to atrazine on pubertal and postnatal reproductive indices in the female rat. Reproductive Toxicology, v. 32, n. 1, p. 43-51, 2011. DOI: 10.1016/j.reprotox.2011.04.004 [ Links ]
DE CASTRO, V. L. S. S. et al. Evaluation of neurodevelopmental effects on rats exposed prenatally to sulfentrazone. NeuroToxicology, v. 28, n. 6, p. 1249-1259, 2007a. DOI: 10.1016/j.neuro.2007.06.001 [ Links ]
DE CASTRO, V. L. S. S. et al. Neurodevelopmental effects of perinatal fenarimol exposure on rats. Reproductive Toxicology, v. 23, n. 1, p. 98-105, 2007b. DOI: 10.1016/j. reprotox.2006.09.001 [ Links ]
DELCLOS, K. B. et al. Overlapping but distinct effects of genistein and ethinyl estradiol (EE2) in female Sprague-Dawley rats in multigenerational reproductive and chronic toxicity studies. Reproductive Toxicology, v. 27, n. 2, p. 117-132, 2009. DOI: 10.1016/j. reprotox.2008.12.005 [ Links ]
DIAZ, M. R. et al. Repeated intermittent alcohol exposure during the third trimester equivalent increases expression of the GABAA receptor γ subunit in cerebellar granule neurons and delays motor development in rats. Neuropharmacology, v. 79, p. 262-274, 2014. DOI: 10.1016/j.neuropharm.2013.11.020 [ Links ]
DOBRZYŃSKA, M. M.; TYRKIEL, E. J.; PACHOCKI, K. A. Developmental toxicity in mice following paternal exposure to Di-N-Butyl-Phthalate (DBP). Biomedical and Environmental Sciences, v. 24, n. 5, p. 569-578, 2011. DOI: 10.3967/0895-3988. 2011.05.017 [ Links ]
DOMMETT, E. J.; ROSTRON, C. L. Abnormal air righting behaviour in the spontaneously hypertensive rat model of ADHD. Experimental Brain Research, v. 215, n. 1, p. 45-52, 2011. DOI: 10.1007/s00221-011-2869-7 [ Links ]
DORCE, A. L. C. et al. Effects of prenatal exposure to Tityus bahiensis scorpion venom on rat offspring development. Reproductive Toxicology, v. 28, n. 3, p. 365-370, 2009. DOI: 10.1016/j.reprotox.2009.04.008 [ Links ]
DU, G. et al. Neonatal and juvenile exposure to perfluorooctanoate (PFOA) and perfluorooctane sulfonate (PFOS): advance puberty onset and kisspeptin system disturbance in female rats. Ecotoxicology and Environmental Safety, v. 167, p. 412-421, 2019. DOI: 10.1016/j.ecoenv.2018.10.025 [ Links ]
FARAG, A. T. et al. Effects of oral exposure of synthetic pyrethroid, cypermethrin on the behavior of F1-progeny in mice. Reproductive Toxicology, v. 23, n. 4, p. 560-567, 2007. DOI: 10.1016/j.reprotox.2007.01.002 [ Links ]
FAVARETO, A. P. A.; TOLEDO, F. C.; KEMPINAS, W. G. Paternal treatment with cisplatin impairs reproduction of adult male offspring in rats. Reproductive Toxicology, v. 32, n. 4, p. 425-433, 2011. DOI: 10.1016/j.reprotox.2011.10.003 [ Links ]
FENG, L. et al. Long-term effects of lanthanum intake on the neurobehavioral development of the rat. Neurotoxicology and Teratology, v. 28, n. 1, p. 119-124, 2006. DOI: 10.1016/j.ntt.2005.10.007 [ Links ]
FENG, X. et al. Exposure of pregnant mice to perfluorobutanesulfonate causes hypothyroxinemia and developmental abnormalities in female offspring. Toxicological Sciences, v. 155, n. 2, p. 409-419, 2017. DOI: 10.1093/toxsci/kfw219 [ Links ]
FENTON, S. E. et al. Persistent abnormalities in the rat mammary gland following gestational and lactational exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD). Toxicological Science, v. 67, n. 1, p. 63-74, 2002. DOI: 10.1093/toxsci/67.1.63 [ Links ]
FERGUSON, S. A. et al. Preweaning behaviors, developmental landmarks, and acrylamide and glycidamide levels after pre- and postnatal acrylamide treatment in rats. Neurotoxicology and Teratology, v. 32, n. 3, p. 373-382, 2010. DOI: 10.1016/j. ntt.2010.01.010 [ Links ]
FERGUSON, S. A.; LAW, C. D.; ABSHIRE, J. S. Developmental treatment with bisphenol A or ethinyl estradiol causes few alterations on early preweaning measures. Toxicological Sciences, v. 124, n. 1, p. 149-160, 2011. DOI: 10.1093/toxsci/kfr201 [ Links ]
FOX, W. M. Reflex-ontogeny and behavioral development of the mouse. Animal Behavior, v. 13, n. 2-3, p. 234-241, 1965. DOI: 10.1016/0003-3472(65)90041-2 [ Links ]
FRIEDMAN, J. M. The principles of teratology: are they still true? Birth Defects Research Part A Clinical and Molecular Teratology, v. 88, n. 10, p. 766-768, 2010. DOI: 10.1002/bdra.20697 [ Links ]
FUJII, S. et al. A two-generation reproductive toxicity study of diethyl phthalate (DEP) in rats. The Journal of Toxicological Sciences, v. 30, p. 97-116, 2005. DOI: 10.2131/ jts.30.s97 [ Links ]
GALLEGOS, C. E. et al. Exposure to a glyphosate-based herbicide during pregnancy and lactation induces neurobehavioral alterations in rat offspring. Neurotoxicology,v. 53, p. 20-28, 2016. DOI: 10.1016/j.neuro.2015.11.015 [ Links ]
GERENUTTI, M. et al. The effect of Cecropia glazioui Snethlage on the physical and neurobehavioral development of rats. Die Pharmazie, v. 63, n. 5, p. 398-404, 2008. [ Links ]
GOTARDO, A. T.; GÓRNIAK, S. L. Toxicologia do desenvolvimento. In: SPINOSA, H. S.; GÓRNIAK, S. L; PALERMO-NETO, J. Toxicologia aplicada à medicina veterinária. Barueri: Manole, 2020. p. 459-476. [ Links ]
GRANDE, S. W. et al. A dose-response study following in utero and lactational exposure to di(2-ethylhexyl)phthalate: effects on female rat reproductive development. Toxicological Sciences, v. 91, n. 1-2, p. 247-254, 2006. DOI: 10.1016/j.tox.2006.10.005 [ Links ]
GROTE, K. et al. Effects of in utero and lactational exposure to triphenyltin chloride on pregnancy outcome and postnatal development in rat offspring. Toxicology, v. 238, n. 2-3, p. 177-185, 2007. DOI: 10.1016/j.tox.2007.05.033 [ Links ]
GROTE, K. et al. Sex differences in effects on sexual development in rat offspring after pre- and postnatal exposure to triphenyltin chloride. Toxicology, v. 260, n. 1-3, p. 53-59, 2009. DOI: 10.1016/j.tox.2009.03.006 [ Links ]
GUMILAR, F. et al. Locomotor activity and sensory-motor developmental alterations in rat offspring exposed to arsenic prenatally and via lactation. Neurotoxicology and Teratology, v. 49, p. 1-9, 2015. DOI: 10.1016/j.ntt.2015.02.005 [ Links ]
HEMMINGS, S. J; BARKER, L. The effects of dietary flaxseed on the Fischer 344 rat: I. Development, behaviour, toxicity and the activity of liver γ-glutamyltranspeptidase. Cell Biochemistry and Function, v. 22, n. 2, p. 113-121, 2004. DOI: 10.1002/cbf.1058 [ Links ]
HEULAND, E. et al. Prenatal MDMA exposure delays postnatal development in the rat: a preliminary study. Neurotoxicology and Teratology, v. 32, n. 4, p. 425-431, 2010. DOI: 10.1016/j.ntt.2010.03.006 [ Links ]
HEYNS, C. F.; HUTSON, J. M. Historical review of theories on testicular descent. The Journal of Urology, v. 153, p. 754-767, 1995. [ Links ]
HIRATA-KOIZUMI, M. et al. Two-generation reproductive toxicity study of aluminium sulfate in rats. Reproductive Toxicology, v. 31, n. 2, p. 219-230, 2011. DOI: 10.1016/j. reprotox.2010.11.004 [ Links ]
HOATH, S. B. Treatment of the neonatal rat with epidermal growth factor: differences in time and organ response. Pediatric Research, v. 20, n. 5, p. 468-472, 1986. DOI: 10.1203/00006450-198605000-00017 [ Links ]
HOLSON, R. R.; COGAN, J. E.; ADAMS, J. Gestational retinoic acid exposure in the rat: effects of sex, strain and exposure period. Neurotoxicology and Teratology, v. 23, n. 2, p. 147-156, 2001. DOI: 10.1016/s0892-0362(01)00133-7 [ Links ]
HONMA, S. et al. Low dose effect of in utero exposure to bisphenol A and diethylstilbestrol on female mouse reproduction. Reproductive Toxicology, v. 16, n. 2, p. 117-122, 2002. DOI: 10.1016/s0890-6238(02)00006-0 [ Links ]
HOVEY, R. C. et al. Quantitative assessment of mammary gland development in female long evans rats following in utero exposure to atrazine. Toxicological Sciences, v. 119, n. 2, p. 380-390, 2011. DOI: 10.1093/toxsci/kfq337 [ Links ]
HU, J. et al. Short-term neonatal/prepubertal exposure of dibutyl phthalate (DBP) advanced pubertal timing and affected hypothalamickisspeptin/GPR54 expression differently in female rats. Toxicology, v. 314, n. 1, p. 65-75, 2013. DOI: 10.1016/j. tox.2013.09.007 [ Links ]
HYOUNG, U. et al. Developmental toxicity by exposure to bisphenol A diglycidyl ether during gestation and lactation period in sprague-dawley male rats. Journal of Preventive Medicine and Public Health, v. 40, n. 2, p. 155-161, 2007. DOI: 10.3961/jpmph.2007.40.2.155 [ Links ]
JAGETIAN, G. C.; BALIGA, M. S. Induction of developmental toxicity in mice treated with Alstonia scholaris (Sapthaparna) in utero. Birth Defects Research (Part B), v. 68, n. 6, p. 472-478, 2003. DOI: 10.1002/bdrb.10047 [ Links ]
KAIZAKI, A. et al. Maternal MDMA administration in mice leads to neonatal growth delay. The Journal of Toxicological Science, v. 39, n. 1, p. 33-39, 2014. DOI: 10.2131/jts.39.33 [ Links ]
KAKEYAMA, M.; SONE, H.; TOHYAMA, C. Perinatal exposure of female rats to 2,3,7,8-tetrachlorodibenzop-dioxin induces central precocious puberty in the offspring. Journal of Endocrinology, v. 197, n. 2, p. 351-358, 2008. DOI: 10.1677/JOE-08-0062 [ Links ]
KAKITANI, F. T. et al. How many Babinski's signs are there? Arquivos de Neuro-Psiquiatria, v. 68, n. 4, p. 662-665, 2010. DOI: 10.1590/s0004-282x2010000400037 [ Links ]
KANG, K. S.; CHEY, J. H.; LEE, Y. S. Lack of adverse effects in the F1 offspring maternally exposed to genistein at human intake dose level. Food and Chemical Toxicology,v. 40, n. 1, p. 43-51, 2002. DOI: 10.1016/s0278-6915(01)00091-6 [ Links ]
KATAKURA, Y. et al. Effects of prenatal styrene exposure on postnatal development and brain serotonin and catecholamine levels in rats. Environmental Research Section A,v. 85, n. 1, p. 41-47, 2001. DOI: 10.1006/enrs.2000.4053 [ Links ]
KHALKI, H. et al. Prenatal exposure to tobacco extract containing nicotinic alkaloids produces morphological and behavioral changes in newborn rats. Pharmacology, Biochemistry and Behavior, v. 101, n. 3, p. 342-347, 2012. DOI: 10.1016/j.pbb.2012.01.020 [ Links ]
KIHARA, T. et al. Effects of prenatal aflatoxin B1 exposure on behaviors of rat offspring. Toxicological Sciences, v. 53, n. 2, p. 392-399, 2000. DOI: 10.1093/toxsci/53.2.392 [ Links ]
KIHARA, T. et al. Effects of prenatal rubratoxin-B exposure on behaviors of mouse offspring. Toxicological Sciences, v. 61, n. 2, p. 368-373, 2001. DOI: 10.1093/toxsci/61.2.368 [ Links ]
KIM, J. C. et al. Peri- and postnatal developmental toxicity of the fluoroquinolone antibacterial DW-116 in rats.Food and Chemical Toxicology, v. 42, n. 3, p. 389-395, 2004. DOI: 10.1016/j.fct.2003.10.002 [ Links ]
KISS, P. et al. Development of neurological reflexes and motor coordination in rats neonatally treated with monosodium glutamate. Neurotoxicity Research, v. 8, n. 3-4, p. 235-244, 2005. DOI: 10.1007/BF03033977 [ Links ]
KROEZE, Y. et al. Perinatal reduction of functional serotonin transporters results in developmental delay. Neuropharmacology, v. 109, p. 96-111, 2016. DOI: 10.1016/j. neuropharm.2016.05.012 [ Links ]
LAU, C. et al. Exposure to perfluorooctane sulfonate during pregnancy in rat and mouse. II: postnatal evaluation. Toxicological Sciences, v. 74, n. 2, p. 382-392, 2003. DOI: 10.1093/toxsci/kfg122 [ Links ]
LAU, C. et al. Effects of perfluorooctanoic acid exposure during pregnancy in the mouse. Toxicological Sciences, v. 90, n. 2, p. 510-518, 2006. DOI: 10.1093/toxsci/kfj105 [ Links ]
LAZARINI, C. A. et al. Prenatal exposure to dichlorvos: physical and behavioral effects on rat offspring. Neurotoxicology and Teratology, v. 26, n. 4, p. 607-614, 2004. DOI: 10.1016/j.ntt.2004.03.006 [ Links ]
LI, J. et al. Effects of prenatal propofol exposure on postnatal development in rats. Neurotoxicology and Teratology, v. 43, p. 51-58, 2014. DOI: 10.1016/j.ntt.2014.03.006 [ Links ]
LI, X. B. et al. Maternal repeated oral exposure to microcystin-LR affects neurobehaviors in developing rats. Environmental Toxicology and Chemistry, v. 34, n. 1, p. 64-69, 2015. DOI: 10.1002/etc.2765 [ Links ]
LIN, Z. et al. Gestational and lactational exposure to atrazine via the drinking water causes specific behavioral deficits and selectively alters monoaminergic systems in C57BL/6 mouse dams, juvenile and adult offspring. Toxicological Sciences, v. 141, n. 1, p. 90-102, 2014. DOI: 10.1093/toxsci/kfu107 [ Links ]
LUO, J. et al. Maternal and early life arsenite exposure impairs neurodevelopment and increases the expression of PSA-NCAM in hippocampus of rat offspring. Toxicology,v. 311, n. 3, p. 99-106, 2013. DOI: 10.1016/j.tox.2013.06.007 [ Links ]
MAKITA, Y. et al. Effects of simultaneous administration of tributyltin (TBT) and p,p′-DDE on female offspring of wistar rats. Journal of Toxicology and Environmental Health, Part A, v. 66, n. 2, p. 2337-2347, 2003. DOI: 10.1080/15287390151126469
MARANGHI, F. et al. Histological and histomorphometric alterations in thyroid and adrenals of CD rat pups exposed in utero to methyl thiophanate. Reproductive Toxicology, v. 17, n. 5, p. 617-623, 2003. DOI: 10.1016/s0890-6238(03)00105-9 [ Links ]
MARKOWSKI, V. P. et al. Effects of prenatal exposure to sodium arsenite on motor and food-motivated behaviors from birth to adulthood in C57BL6/J mice. Neurotoxicology and Teratology, v. 34, n. 2, p. 221-231, 2012. DOI: 10.1016/j.ntt.2012.01.001 [ Links ]
MARKOWSKI, V. P. et al. Motor deficits, impaired response inhibition, and blunted response to methylphenidate following neonatal exposure to decabromodiphenyl ether. Neurotoxicology and Teratology, v. 63, p. 51-59, 2017. DOI: 10.1016/j.ntt. 2017.07.003 [ Links ]
MASKE, P. et al. n-Butylparaben exposure through gestation and lactation impairs spermatogenesis and steroidogenesis causing reduced fertility in the F1 generation male rats. Environmental Pollution, v. 256, p. 1-11, 2020. DOI: 10.1016/j.envpol. 2019.112957 [ Links ]
MATSUURA, I. et al. Evaluation of a two-generation reproduction toxicity study adding endpoints to detect endocrine disrupting activity using lindane. The Journal of Toxicological Sciences, v. 30, p. 135-161, 2005. DOI: 10.2131/jts.30.s135 [ Links ]
MAURICE, N. et al. Short-term effects of a perinatal exposure to the HBCDDα-isomer in rats: assessment of early motor and sensory development, spontaneous locomotor activity and anxiety in pups. Neurotoxicology and Teratology, v. 52, p. 170-180, 2015. DOI: 10.1016/j.ntt.2015.08.005 [ Links ]
MAURISSEN, J. P. J. et al. Lack of selective developmental neurotoxicity in rat pups from dams treated by gavage with chlorpyrifos. Toxicological Sciences, v. 57, n. 2, p. 250-263, 2000. DOI: 10.1093/toxsci/57.2.250 [ Links ]
MCDONNELL-DOWLING, K.; KELLY, J. P. The consequences of prenatal and/or postnatal methamphetamine exposure on neonatal development and behaviour in rat offspring. International Journal of Developmental Neuroscience, v. 47(Pt B), p. 147-156, 2015. DOI: 10.1016/j.ijdevneu.2015.08.006 [ Links ]
MEEK, L. R. et al. Acute paternal alcohol use affects offspring development and adult behavior. Physiology & Behavior, v. 91, n. 1, p. 154-160, 2007. DOI: 10.1016/j.physbeh.2007.02.004 [ Links ]
MENSHANOV, P. N.; BANNOVA, A. V.; DYGALO, N. N. Toxic effects of lithium chloride during early neonatal period of rat development. Bulletin of Experimental Biology and Medicine, v. 160, n. 4, p. 459-461, 2016. DOI: 10.1007/s10517-016-3196-6 [ Links ]
MOORE, C. L. et al. Developmental neurotoxicity of inorganic arsenic exposure in Sprague-Dawley rats. Neurotoxicology and Teratology, v. 72, p. 49-57, 2019. DOI: 10.1016/j.ntt.2019.01.007 [ Links ]
MOORE, R. W. et al. Abnormalities of sexual development in male rats with in utero and lactational exposure to the antiandrogenic plasticizer di(2-ethylhexyl) phthalate. Environmental Health Perspectives, v. 109, n. 3, p. 229-237, 2001. DOI: 10.1289/ehp. 01109229 [ Links ]
MORAES, A. P. et al. Maternal exposure to diphenhydramine during the fetal period in rats: effects on physical and neurobehavioral development and on neurochemical parameters. Neurotoxicology and Teratology, v. 26, n. 5, p. 681-692, 2004. DOI: 10.1016/j.ntt.2004.04.008 [ Links ]
MOSER, V. C. et al. Neurotoxicological and thyroid evaluations of rats developmentally exposed to tris(1,3-dichloro-2-propyl)phosphate (TDCIPP) and tris(2-chloro-2-ethyl) phosphate (TCEP). Neurotoxicology and Teratology, v. 52, p. 236-247, 2015. DOI: 10.1016/j.ntt.2015.08.004 [ Links ]
MÜLLER, D. R. et al. Neonatal isoflavone exposure interferes with the reproductive system of female Wistar rats. Toxicology Letters, v. 16, p. 39-48, 2016. DOI: 10.1016/j. toxlet.2016.08.001 [ Links ]
NAM, S. M. et al. Effects of ascorbic acid on osteopontin expression and axonal myelination in the developing cerebellum of lead-exposed rat pups. International Journal of Environmental Research and Public Health, v. 16, n. 6, p. 1-13, 2019. DOI: 10.3390/ ijerph16060983 [ Links ]
NASSR, A. C. C. et al. Effects of gestational and lactational fenvalerate exposure on immune and reproductive systems of male rats. Journal of Toxicology and Environmental Health, Part A: Current Issues, v. 73, n. 13-14, p. 952-964, 2010. DOI: 10.1080/ 15287391003751745 [ Links ]
NEGRO-VILLAR, A.; OJEDA, S. R.; MCCANN, S. M. Evidence for changes in sensitivity to testosterone negative feedback on gonadotropin release during sexual developmente in the male rat. Endocrinology, v. 93, n. 3, p. 729-735, 1973. DOI: 10.1210/ endo-93-3-729 [ Links ]
NGUON, K.; BAXTER, M. G.; SAJDEL-SULKOWSKA, E. M. Perinatal exposure to polychlorinated biphenyls differentially affects cerebellar development and motor functions in male and female rat neonates. The Cerebellum, v. 4, n. 2, p. 112-122, 2005. DOI: 10.1080/14734220510007860 [ Links ]
NIKAIDO, Y. et al. Effects of maternal xenoestrogen exposure on development of the reproductive tract and mammary gland in female CD-1 mouse offspring. Reproductive Toxicology, v. 18, n. 6, p. 803-811, 2004. DOI: 10.1016/j.reprotox.2004.05.002 [ Links ]
ODUM, J. et al. Comparison of the developmental and reproductive toxicity of diethylstilbestrol administered to rats in utero, lactationally, preweaning, or postweaning. Toxicological Sciences, v. 68, n. 1, p. 147-163, 2002. DOI: 10.1093/toxsci/68.1.147 [ Links ]
OGATA, R. et al. Two-generation reproductive toxicity study of tributyltin chloride in female rats. Journal of Toxicology and Environmental Health, Part A, v. 63, n. 2, p. 127-144, 2001. DOI: 10.1080/15287390151126469 [ Links ]
ORGANISATION FOR ECONOMIC COOPERATION AND DEVELOPMENT. Guidelines for testing chemical: prenatal development toxicity study. Paris: OECD, 2018. [ Links ]
PALANZA, P.; PARMIGIANI, S.; VOM SAAL, F. S. Effects of prenatal exposure to low doses of diethylstilbestrol, o,p'DDT, and methoxychlor on postnatal growth and neurobehavioral development in male and female mice. Hormones and Behavior, v. 40, p. 252-265, 2001. DOI: 10.1006/hbeh.2001.1697 [ Links ]
PATIN, V. et al. Does prenatal stress affect the motoric development of rat pups? Developmental Brain Research, v. 149, n. 2, p. 85-92, 2004. DOI: 10.1016/j.devbrainres.2003.12.008 [ Links ]
PELLIS, S. M. et al. Visual modification of vestibularly triggered air-righting in the rat. Behavioral Bain Research, v. 35, n. 2, p. 23-26, 1989. DOI: 10.1016/s01664328(05)80108-1 [ Links ]
PINAZO-DURÁN, M. D. et al. Thyroid hormone deficiency disrupts rat eye neurodevelopment. Brain Research, v. 1392, p. 16-26, 2011. DOI: 10.1016/j.brainres. 2011.04.005 [ Links ]
PODGORAC, J. et al. Early physical and motor development of mouse offspring exposed to valproic acid throughout intrauterine development. Behavioural Brain Research,v. 311, p. 99-109, 2016. DOI: 10.1016/j.bbr.2016.05.023 [ Links ]
POMETLOVÁ, M. et al. Cross-fostering effect on postnatal development of rat pups exposed to methamphetamine during gestation and preweaning periods. International Journal of Development Neuroscience, v. 27, n. 2, p. 149-155, 2009. DOI: 10.1016/j. ijdevneu.2008.11.006 [ Links ]
RAYNER, J. L.; WOOD, C.; FENTON, S. E. Exposure parameters necessary for delayed puberty and mammary gland development in Long-Evans rats exposed in utero to atrazine. Toxicology and Applied Pharmacology, v. 195, n. 1, p. 2-34, 2004. DOI: 10.1016/j.taap.2003.11.005 [ Links ]
RIECKE, K. et al. Developmental toxicity of the HIV-protease inhibitor indinavir in rats. Teratology, v. 62, n. 5, p. 291-300, 2000. DOI: 10.1002/1096-9926(200011)62:5<291::AID-TERA3>3.0.CO;2-A [ Links ]
ROCKETT, J. C. et al. Effect of conazole fungicides on reproductive development in the female rat. Reproductive Toxicology, v. 22, n. 4, p. 647-658, 2006. DOI: 10.1016/j.reprotox.2006.05.008 [ Links ]
RODRÍGUEZ, P. E. A.; SANCHEZ, M. S. Maternal exposure to triclosan impairs thyroid homeostasis and female pubertal development in wistar rat offspring. Journal of Toxicology and Environmental Health, Part A: Current Issues, v. 73, n. 24, p. 1678-1688, 2010. DOI: 10.1080/15287394.2010.516241 [ Links ]
RUIZ-PINO, F. et al. Environmentally relevant perinatal exposures to bisphenol A disrupt postnatal Kiss1/NKB neuronal maturation and puberty onset in female mice. Environmental Health Perspectives, v. 127, n. 10, p. 1-14, 2019. DOI: 10.1289/EHP5570 [ Links ]
RYAN, B. C. et al. In utero and lactational exposure to bisphenol A, in contrast to ethinyl estradiol, does not alter sexually dimorphic behavior, puberty, fertility, and anatomy of female LE rats. Toxicological Sciences, v. 114, n. 1, p. 133-148, 2010. DOI: 10.1093/toxsci/kfp266 [ Links ]
SALLES-GOMES, C. O. M.; GARCIA, J. S.; SPINOSA, H. S. Toxicologia dos medicamentos. In: SPINOSA, H. S.; GÓRNIAK, S. L.; PALERMO-NETO, J. Toxicologia aplicada à medicina veterinária. Barueri: Manole, 2020. p. 3-10. [ Links ]
SANDINI, T. M. et al. Prenatal exposure to integerrimine N-oxide impaired the maternalcare and the physical and behavioral development of offspring rats. International Journal of Developmental Neuroscience, v. 36, p. 53-63, 2014. DOI: 10.1016/j.ijdevneu.2014.05.007 [ Links ]
SARPA, M. et al. Postnatal development and fertility of offspring from mice exposed to triphenyltin (fentin) hydroxide during pregnancy and lactation. Journal of Toxicology and Environmental Health, Part A: Current Issues, v. 73, n. 13-14, p. 965-971, 2010. DOI: 10.1080/15287391003751752 [ Links ]
SCHWARZ, A. et al. Effects of Ipomoea carnea aqueous fraction intake by dams during pregnancy on the physical and neurobehavioral development of rat offspring. Neurotoxicology and Teratology, v. 25, n. 5, p. 615-626, 2003. DOI: 10.1016/s08920362(03)00078-3 [ Links ]
ŠEVČÍKOVÁ, M. et al. The influence of methamphetamine on maternal behavior and development of the pups during the neonatal period. International Journal of Developmental Neuroscience, v. 59, p. 37-46, 2017. DOI: 10.1016/j.ijdevneu.2017.03.005 [ Links ]
SHEN, W. et al. Selenium protects reproductive system and foetus development in a rat model of gestational lead exposure. European Review for Medical and Pharmacological Sciences, v. 20, n. 4, p. 773-780, 2016. [ Links ]
SI, J. et al. Effects of perinatal exposure to low doses of tributyltin chloride on pregnancy outcome and postnatal development in mouse offspring. Environmental Toxicology, v. 27, n. 10, p. 605-612, 2011. DOI: 10.1002/tox.20753 [ Links ]
SIDDIQUI, W. H. et al. A two-generation reproductive toxicity study of decamethylcyclopentasiloxane (D5) in rats exposed by whole-body vapor inhalation. Reproductive Toxicology, v. 23, n. 2, p. 216-225, 2007. DOI: 10.1016/j.reprotox.2006.11.006 [ Links ]
SILVA, T. C. L. et al. Maternal resveratrol treatment reduces the risk of mammary carcinogenesis in female offspring prenatally exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin. Hormones and Cancer, v. 8, n. 5-6, p. 286-297, 2017. DOI: 10.1007/s12672017-0304-7 [ Links ]
SILVA, V. et al. Ethanol embryofetotoxicity in malnourished rats. Nutrition Reports Internacional, v. 36, p. 887-895, 1987. [ Links ]
SINGH, D. et al. Perinatal exposure of pregnant rats to cypermethrin delays testicular descent, impairs fertility in F1 male progeny leading to developmental defects in F2 generation. Chemosphere, v. 185, p. 376-385, 2017. DOI: 10.1016/j.chemosphere. 2017.06.138 [ Links ]
SITAREK, K.; GRALEWICZ, S. Early developmental effects of separate or combined perinatal exposure to methylmercury (MgHg) and 2,2',4,4',5,5'-hexachlorobiphenyl (PCP 153) in the rat. International Journal of Occupational Medicine and Environmental Health, v. 22, n. 2, p. 89-105, 2009. DOI: 10.2478/v10001-009-0015-6 [ Links ]
SLAMBEROVA, R.; POMETLOVA, M.; CHAROUSOVA, P. Postnatal development of rat pups is altered by prenatal methamphetamine exposure. Progress in Neuro-Psychopharmacology & Biological Psychiatry, v. 30, n. 1, p. 82-88, 2006. DOI: 10.1016/j.pnpbp. 2005.06.006 [ Links ]
SMART, J. L. et al. Epidermal growth factor advances some aspects of development but retards others in both rats and hamsters. Journal of Development Physiology, v. 11, n. 3, p. 153-158, 1989. [ Links ]
SMITH, E. R.; DAMASSA, D. A.; DAVIDSON, J. M. Feedback regulation and male puberty: testosterone-luteinizing hormone relationships in the developing male rat. Endocrinology, v. 101, n. 1, p. 173-180, 1977. DOI: 10.1210/endo-101-1-173 [ Links ]
SODERSTEIN, P.; ENEROTH, P. Effects of exposure to pups on maternal behavior, sexual behavior and serum prolactin concentrations in male rat. Journal of Endocrinology,v. 102, n. 1, p. 115-119, 1984. DOI: 10.1677/joe.0.1020115 [ Links ]
SOUZA, A. C. et al. Maternal caffeine exposure alters neuromotor development and hippocampus acetylcholinesterase activity in rat offspring. Brain Research, v. 1595, p. 10-18, 2015. DOI: 10.1016/j.brainres.2014.10.039 [ Links ]
SPINOSA, H. S. Considerações gerais sobre os praguicidas. In: SPINOSA, H. S.; GÓRNIAK, S. L.; PALERMO-NETO, J. Toxicologia aplicada à medicina veterinária. Barueri: Manole, 2020. p. 163-169. [ Links ]
SPINOSA, H. S.; FUKUSHIMA, A. R. Introdução à toxicologia veterinária. In: SPINOSA, H. S.; GÓRNIAK, S. L.; PALERMO-NETO, J. Toxicologia aplicada à medicina veterinária. Barueri: Manole, 2020. p. 163-169. [ Links ]
SUGAWARA, N. et al. Developmental and neurobehavioral effects of perinatal exposure to polychlorinated biphenyls in mice. Archives of Toxicology, v. 80, n. 5, p. 286-292, 2006. DOI: 10.1007/s00204-005-0042-4 [ Links ]
SUGAWARA, N. et al. Effects of perinatal coexposure to methylmercury and polychlorinated biphenyls on neurobehavioral development in mice. Archives of Toxicology,v. 82, n. 6, p. 387-397, 2008. DOI: 10.1007/s00204-007-0254-x [ Links ]
SUPRIYA, C. et al. Effects of maternal exposure to aflatoxin B1 during pregnancy on fertility output of dams and developmental, behavioral and reproductive consequences in female offspring using a rat model. Toxicology Mechanisms and Methods, v. 26, n. 3, p. 202-210, 2016. DOI: 10.3109/15376516.2016.1151967 [ Links ]
SUPRIYA, C.; REDDY, P. S. Prenatal exposure to aflatoxin B1: developmental, behavioral, and reproductive alterations in male rats. The Science of Nature, v. 102, n. 5-6, p. 1-13, 2015. DOI: 10.1007/s00114-015-1274-7 [ Links ]
SZAKMÁRY, E. et al. Effects of cobalt sulfate on prenatal development of mice, rats, and rabbits, and on early postnatal development of rats. Journal of Toxicology and Environmental Health, Part A: Current Issues, v. 62, n. 5, p. 367-386, 2001. DOI: 10.1080/152873901300018110 [ Links ]
TANAKA, T. et al. Reproductive and neurobehavioral effects of brilliant blue FCF in mice. Birth Defects Research (Part B), v. 95, n. 6, p. 395-409, 2012. DOI: 10.1002/ bdrb.21029 [ Links ]
THOMAS, J. D.; ABOU, E. J.; DOMINGUEZ, H. D. Prenatal choline supplementation mitigates the adverse effects of prenatal alcohol exposure on development in rats. Neurotoxicology and Teratology, v. 31, n. 5, p. 303-311, 2009. DOI: 10.1016/j.ntt. 2009.07.002 [ Links ]
TINWELL, H. et al. Normal sexual development of two strains of rat exposed in utero to low doses of bisphenol A. Toxicological Sciences, v. 68, n. 2, p. 339-348, 2002. DOI: 10.1093/toxsci/68.2.339 [ Links ]
TORRENTE, M.; COLOMINA, M. T.; DOMINGO, J. L. Effects of prenatal exposure to manganese on postnatal development and behavior in mice: Influence of maternal restraint. Neurotoxicology and Teratology, v. 24, n. 2, p. 219-225, 2002. DOI: 10.1016/ s0892-0362(02)00188-5 [ Links ]
TUCKER, D. K. et al. The mammary gland is a sensitive pubertal target in CD-1 and C57Bl/6 mice following perinatal perfluorooctanoic acid (PFOA) exposure. Reproductive Toxicology, v. 54, p. 26-36, 2015. DOI: 10.1016/j.reprotox.2014.12.002 [ Links ]
UDO, M. S. B. et al. Prenatal exposure to a low fipronil dose disturbs maternal behavior and reflex development in rats. Neurotoxicology and Teratology, v. 45, p. 27-33, 2014. DOI: 10.1016/j.ntt.2014.05.010 [ Links ]
UNITED STATES ENVIRONMENTAL PROTECTION AGENCY. Risk assessment forum. Guidelines for developmental toxicity risk assessment. Federal Register, v. 56, p. 63798-63826, 1991. [ Links ]
WEISENBURGER, W. P.; HAGLER, A. R.; TASSINARI, M. S. Pre- and postnatal development studies of lasofoxifene, a selective estrogen receptor modulator (SERM), in Sprague-Dawley rats. Birth Defects Research (Part B), v. 71, n. 3, p. 171-184, 2004. DOI: 10.1002/bdrb.20013 [ Links ]
WOLF, C. J. et al. Developmental toxicity of perfluorooctanoic acid in the cd-1 mouse after cross-foster and restricted gestational exposures. Toxicological Sciences, v. 95, n. 2, p. 462-473, 2007. DOI: 10.1093/toxsci/kfl159 [ Links ]
XIE, Z. et al. Effects of maternal exposure to di-n-butyl phthalate during pregnancy and breastfeeding on ovarian development and function of F1 female rats. Environmental Toxicology and Pharmacology, v. 43, p. 38-43, 2016. DOI: 10.1016/j.etap. 2016.01.022 [ Links ]
XUYING, W. et al. Effect of astragaloside IV on the general and peripartum reproductive toxicity in Sprague-Dawley rats. International Journal of Toxicology, v. 29, n. 5, p. 505-516, 2010. DOI: 10.1177/1091581810376840 [ Links ]
YAMAMOTO, M. et al. Effects of maternal exposure to diethylstilbestrol on the development of the reproductive system and thyroid function in male and female rat offspring. The Journal of Toxicological Sciences, v. 28, n. 5, p. 385-94, 2003. DOI: 10.2131/jts.28.385 [ Links ]
YAMASAKI, K. et al. Effects of in utero and lactational exposure to tamoxifen in SD rats. Toxicology Letters, v. 156, n. 2, p. 289-296, 2005. DOI: 10.1016/j.toxlet. 2004.12.001 [ Links ]
YAMASAKI, K. et al. Effects of in utero through lactational exposure to dicyclohexyl phthalate and p,p'-DDE in Sprague-Dawley rats. Toxicology Letters, v. 189, n. 1, p. 14-20, 2009. DOI: 10.1016/j.toxlet.2009.04.023 [ Links ]
YOSHIDA, M. et al. Induction of different types of uterine adenocarcinomas in Donryu rats due to neonatal exposure to high-dose p-t-octylphenol for different periods. Carcinogenesis, v. 23, n. 10, p. 1745-1750, 2002. DOI: 10.1093/carcin/23.10.1745 [ Links ]
YOSHIDA, M. et al. Maternal exposure to low doses of bisphenol A has no effects on development of female reproductive tract and uterine carcinogenesis in Donryu rats. Journal of Reproduction and Development, v. 50, n. 3, p. 349-360, 2004. DOI: 10.1262/ jrd.50.349 [ Links ]
YOU, L. et al. Combined effects of dietary phytoestrogen and synthetic endocrine-active compound on reproductive development in Sprague-Dawley rats: genistein and methoxychlor. The Journal of Toxicological Sciences, v. 66, n. 1, p. 91-104, 2002. DOI: 10.1093/toxsci/66.1.91 [ Links ]
YU, F. et al. Effects of in utero meso-2,3-dimercaptosuccinic acid with calcium and ascorbic acid on lead-induced fetal development. Archives of Toxicology, v. 82, n. 7, p. 453-459, 2008. DOI: 10.1007/s00204-007-0267-5 [ Links ]
ZHAO, W. et al. Assessment of neurotoxic effects and brain region distribution in rat offspring prenatally co-exposed to low doses of BDE-99 and methylmercury. Chemosphere, v. 112, p. 170-176, 2014. DOI: 10.1016/j.chemosphere.2014.04.011 [ Links ]
ZHAO, X. et al. Effects of paternal cadmium exposure on the sperm quality of male rats and the neurobehavioral system of their offspring. Experimental and Therapeutic Medicine, v. 10, n. 6, p. 2356-2360, 2015. DOI: 10.3892/etm.2015.2777 [ Links ]
ZHANG, X. et al. Impairment of ovaries by 2,3,7,8-Tetrachlorobenzo-p-dioxin (TCDD) exposure in utero associated with BMP15 and GDF9 in the female offspring rat. Toxicology, v. 410, p. 16-25, 2018. DOI: 10.1016/j.tox.2018.08.015 [ Links ]
ZHANG, X. et al. Role of epigenetic regulation of Igf2 and H19 in 2,3,7,8-Tetrachlorobenzo-pdioxin (TCDD)-induced ovarian toxicity in offspring rats. Toxicology Letters,v. 311, p. 98-104, 2019. DOI: 10.1016/j.toxlet.2019.04.034 [ Links ]
Recebido em: 10/06/2020
Aprovado em: 13/08/2020
Agradecemos a Chairim Arrais pela elaboração das figuras ilustrativas.














