Serviços Personalizados
Journal
artigo
Indicadores
Compartilhar
Revista de Etologia
versão impressa ISSN 1517-2805
Rev. etol. vol.9 no.1 São Paulo jan. 2010
Artigo
Etograma do Eira barbara (Carnivora: Mustelidae) em cativeiro
Ethogram of Eira barbara in captivity
Roberta Laurentino Alves Pereira; Maria Adélia Borstelmann de Oliveira*
Universidade Federal Rural de Pernambuco
RESUMO
Neste trabalho foi elaborado um etograma e analisados os efeitos qualitativos e quantitativos das diferenças de gênero de um casal de Eira barbara (Carnivora: Mustelidae) em cativeiro. Os dados foram coletados no Zoológico do Parque Estadual Dois Irmãos, Recife – PE, no período de abril a outubro de 2005. Para o etograma, utilizou-se o método Ad Libitum, no horário das 07:00h às 17:00h. Em seguida foram realizadas observações sistemáticas através de Varredura Instantânea para a distribuição do comportamento em um total de 100h. Foram obtidas então 58 condutas comportamentais agrupadas em duas categorias: Individual, com 40 diferentes comportamentos divididos em oito subcategorias; e Social, com 18 comportamentos divididos em três subcategorias. Deste total os comportamentos tentar cópula, carregar o outro, agarrar, vocalizar e urinar sobre foram exclusivos ou preferencialmente exibidos pelo macho; e ser carregado, tentar pegar, esfregar genitália, molhar-se, brincar, caçar e carregar comedouro e rosnar pela fêmea.
Palavras-chave: Mustelidae. Etograma. Diferenças de gênero.
ABSTRACT
An ethogram was described and the qualitative and quantitative effects of gender differentiation was analyzed for a male and female Eira barbara (Carnivora: Mustelidae) in captivity. The study was carried out at the Dois Irmãos Zoological Park in Recife, PE Brazil, from April to October, 2005. Observations were made from 07:00h to 17:00h. An ad libitum method was followed for ethogram building, and instantaneous scan sampling for systematic observations (total of 100h observation time). Behavioral categories were grouped into two divisions, individual (40 categories), separated into seven subdivisions; and social (18 categories) separated into two subcategories. Behavior patterns that were exclusively or preferentially exhibited by the male included: attempting to copulate, carrying, grasping, vocalizing, and urinating on; the females main behavior categories included: to be carried, attempting to grasp, genital scent marking, getting wet, playing, hunting, carrying the feeding bowl and growling .
Keywords: Mustelidae. Ethogram. Gender differentiation.
A destruição dos habitats naturais é o problema mais sério enfrentado pelos animais selvagens nos dias atuais e os zoológicos têm sido apontados como o último refúgio para abrigar programas de reprodução e reintrodução. Zoológicos tornaram-se Arcas de Noé por abrigar espécies extintas na natureza ou ameaçadas (Bulbeck, 2005).
Pitsko (2003) relata que a pesquisa etológica é de alta prioridade para zoológicos, por proporcionar a melhor maneira de abordar as questões envolvendo o bem estar animal e projetar melhores ambientes voltados para eles. O estudo do comportamento de animais em cativeiros nos leva a entender como as condições restritas de um recinto zoológico vêm modificar o comportamento natural dos animais e a observar quais as alternativas que estes encontraram para se adaptar a uma vida cativa (Peixoto, 1998). Leva-nos também a desenvolver planos de manejo adequados a efetiva conservação das espécies.
O Zoológico de Dois Irmãos, onde foi desenvolvida a presente pesquisa, ocupa uma área de cerca de 14 ha (Weber & Rezende, 1998). De um plantel de 600 animais encontram-se 32 espécies de mamíferos, entre eles o papa mel (Eira barbara, Linnaeus 1758), também denominado irara, palavra que em Tupi-guarani significa comedor de mel. Segundo Nowak (2005) esta espécie é longeva para seu tamanho corporal, podendo viver até 18 anos em cativeiro. Nativos de florestas tropicais (Emmons & Feer, 1990), sua coloração varia com a localização e com a subespécie, mas, em geral, possuem pelo escuro, com a cabeça dourada, e uma mancha amarela na base da garganta, de formato variável individualmente. São diurno-crepusculares, com grandes áreas de uso, e abrigam-se em árvores ocas, tocas construídas por outros animais, e ocasionalmente em grama alta (Nowak, 2005). Podem se deslocar solitariamente ou, mais freqüentemente, aos pares (macho-fêmea). Onívoros, alimentam-se de pequenos vertebrados, frutas, invertebrados e favos de mel (Emmons & Feer, 1990; Nowak, 2005; Presley 2000; Reid, 1998).
Este trabalho representa o primeiro esforço de elaboração de um etograma para a espécie, descrevendo comportamentos individuais e sociais de um casal de papa mel em cativeiro. Revisões amplas sobre a espécie que incluem descrições dos padrões comportamentais podem ser encontradas em Presley (2000) e Audet (1998). Em ambas encontram-se informações esporádicas de observação tanto no ambiente natural, quando no cativeiro. Mais recentemente a espécie foi alvo de alguns estudos de enriquecimento ambiental (Fernandes & Bochiglieri, 2005) no zoológico de Brasília, publicados na forma de resumos, em congressos nacionais.
O presente trabalho objetivou a confecção de um etograma para Eira barbara, abordando aspectos qualitativos (categorizações e definição de unidades comportamentais) e quantitativos, e revelou diferenças de gênero com implicações diretas no manejo da espécie em cativeiro.
Método
O projeto foi desenvolvido no Zoológico do Parque Estadual Dois Irmãos - PEDI, Recife – PE, entre os meses de abril a outubro de 2005.
Animais e área
O foco da observação dos três indivíduos – dois machos adultos (denominados macho I e macho II) e uma fêmea adulta – recaiu sobre a fêmea e o macho I, por se encontrarem sempre juntos no recinto. O macho II permaneceu, a maior parte do tempo, na área de cambiamento; sendo solto diariamente por cerca de 10 min, tempo necessário para executar a limpeza dessa área. Estes indivíduos, resgatados já adultos pelo Centro de Triagem de Animais Silvestres – CETAS/IBAMA de Pernambuco, foram oficialmente translocados para o zoológico do PEDI entre o ano de 1998 e 2002.
O recinto possuía uma área total de 85m2, 4m2 de cambiamento, e altura de 2,35m, sem cobertura, com uma rampa, um fosso sem água, troncos para deslocamento e troncos ocos que serviam como tocas, suspensas por toras de madeira, solo com vegetação rasteira, comedouro e bebedouro. Os animais recebiam alimentação diariamente em duas bandejas plásticas, entre 10:00h e 11:00h, composta de frutas e carne bovina ou frutas e ração canina, que permanecia no recinto até às 17:00h.
Observação do animal
O etograma foi desenvolvido pelo método contínuo (ad libitum) no horário de atividade do animal (das 07:00h às 17:00h) entre os meses de abril a junho de 2005, mas também incorporou padrões comportamentais que foram exibidos ao longo das observações sistemáticas, ou mesmo, fora desse período. O método de varredura instantânea seguiu esta fase, nos mesmos horários, entre os meses de julho a outubro de 2005. As observações, que duravam duas horas cada, foram realizadas por três semanas/mês, durante cinco dias/semana. Eram realizadas 25 varreduras diárias (a cada 5 min, sendo 1 min de observação e 4 min de intervalo), alcançando 30 h/mês e totalizando 100 horas de observação.
Resultados
Foram identificados e descritos 58 diferentes padrões de comportamento, subdivididos nas categorias: individual e social. Diferenças de gênero, em cada uma das categorias e subcategorias propostas, foram analisadas.
Comportamentos individuais
Comportamentos não dirigidos cuja emissão independe da presença ou proximidade de outro animal. São 40 padrões, divididos em 8 subcategorias.
Alimentação
1. Beber (BB) – consumir água ou qualquer outro líquido.
2. Comer (CM) – levar a boca e mastigar alimentos de origem animal ou vegetal.
3. Carregar comedouro (CD) – arrastar o comedouro para alguma parte do recinto.
4. Carregar comida (CC) – pegar comida do comedouro e levar para outro local.
5. Esconder comida (EC) – retirar comida do comedouro e enterrá-la em alguma parte do recinto.
6. Caçar (CÇ) – ato de perseguir animais com o intuito de se alimentar deles.
7. Forragear (FO) – cavar o solo à procura de comida.
Estereotipia
Representa os comportamentos que não fazem parte do contexto natural da espécie e parecem ter função de aliviar tensões. Em geral estes comportamentos desenvolvem-se sob situação de cativeiro não sendo observados em animais de vida livre.
8. Coprofagia (CP) – ato de ingerir fezes.
9. Mastigar capim (MC) – arrancar e morder ramos vegetais, sem ingeri-los.
10. Pacing (PC) – comportamento de andar de um lado para o outro, de modo repetitivo, com movimento bamboleante da cabeça a cada virada de direção.
Manutenção
Termo aqui usado para designar padrões comportamentais resultantes de atividades reflexas ou de manutenção da homeostase.
11. Bocejar (BO) – movimento de abrir amplamente a boca, com os olhos fechados ou parcialmente fechados. Relacionado, geralmente, a um estado de sonolência.
12. Espreguiçar-se (EP) – estirar os membros dianteiros e traseiros alternadamente, esticando simultaneamente o corpo. Associado geralmente ao despertar.
13. Coçar (CO) – esfregar freneticamente alguma parte do corpo com os dentes ou as unhas.
14. Espirrar (ES) – ejetar ar através das narinas, com movimento brusco da cabeça mantendo os olhos fechados.
15. Tossir (TO) – ejetar, forçosamente, ar através da boca. Associado à emissão de um ruído de curta duração.
16. Defecar (DF) – expelir fezes enquanto mantém as patas traseiras agachadas.
17. Urinar (UR) – expelir urina enquanto mantém uma postura agachada (na fêmea), ou agachada com a pata traseira levemente levantada (macho).
Atividade motora
Movimentos corporais de interação com elementos abióticos do recinto, seja ele móvel ou fixo.
18. Brincar (BI) – interagir com objetos móveis (comedouro, galhos, folhas, entre outros), jogando-os para longe, correndo atrás e voltando a pegar.
19. Interagir com o tratador (IT) – Seguir, mordiscar levemente as botas e pular na tentativa de alcançar algum objeto das mãos do tratador.
20. Raspar / Morder (RM) – interagir, geralmente arranhando ou mordendo, substratos duros e fixos do recinto como grades ou troncos secos da ambientação. Não acompanhado de ingestão dos eventuais pedaços retirados com estes atos.
Marcação/Limpeza
Comportamentos usados para demarcar território, ou para se manter limpo.
21. Esfregar genitália (EG) – Esfregar a região genital em um substrato.
22. Esfregar rosto (ER) – Mover repetidas vezes o rosto ou o pescoço em alguma superfície com intuito de se livrar de restos de comida ou do cheiro do outro indivíduo.
23. Espojar-se (EJ) – esfregar o corpo, particularmente o dorso, na grama ou na areia do recinto.
24. Chacoalhar (CH) – Balançar a cabeça ou todo o corpo rapidamente.
25. Lamber (LA) – Lamber qualquer parte do corpo, inclusive a região ano-genital.
26. Molhar-se (ML) – deitar em uma poça dágua.
27. Urinar sobre (US) – Urinar no mesmo local onde outrem urinou ou defecou nos últimos cinco minutos.
Exploração
Atividades de investigação do ambiente.
28. Analisar (AL) – Observar atentamente pesquisador, tratador, recinto ou outro animal.
29. Cavar (CA) – Arranhar o chão com uma ou duas patas.
30. Farejar (FA) – Investigar o ambiente, com o focinho direcionado ao substrato ou ar, cheirando.
31. Tentar Pegar (TP) – Esticar a pata com o objetivo de alcançar algo que se encontra fora do recinto.
Locomoção
Reuniu comportamentos ligados ao deslocamento horizontal ou vertical do animal.
32. Andar (AN) – Deslocar-se de forma lenta.
33. Correr (CR) – Deslocar-se de forma rápida.
34. Escalar (EC) – Subir, ou descer, o tronco ou a grade lentamente.
35. Pular (PU) – Subir, ou descer, o tronco ou a grade pulando.
Descanso
Reuniu comportamentos ligados ao estado estacionário que envolveu atenção ou desatenção do animal em relação ao ambiente.
36. Descansar (DS) – Postura deitada, com os membros soltos e olhos fechados ou semicerrados, na qual o animal não reage aos estímulos do ambiente por pelo menos cinco minutos.
37. Estar Deitado (DE) – Postura deitada com os membros soltos, olhos abertos atentos ao ambiente e animal reativo aos estímulos externos.
38. Estar Sentado (SE) – Postura com o tórax elevado, patas dianteiras estendidas e próximas das patas traseiras flexionadas, parte traseira do corpo em contato com o substrato.
39. Estar Parado (PA) – Posição em pé estacionária, apoiado sobre as quatro patas, olhos abertos.
40. Parado Bípede (PB) – Posição em pé estacionária com as patas dianteiras apoiadas na grade ou parede e patas traseiras apoiadas no solo.
Comportamentos Sociais
Esta categoria incluiu as interações diretas entre os indivíduos. Dentro desta categoria foram encontrados duas subcategorias e 18 padrões, divididos em:
Afiliativo
Termo utilizado para descrever os comportamentos que atuavam de maneira a estreitar os laços afetivos entre os animais.
41. Aproximar-se (AP) Andar em direção ao outro animal.
42. Brincar com o outro (BR) Interagir com o outro animal através de patadas e arranhões leves e mordiscos.
43. Coçar o outro (CT) Arranhar outro animal com os dentes, ou patas.
44. Lamber o outro (LO) Lamber outro animal.
45. Seguir (SG) Acompanhar em conjunto outro animal.
46. Vocalizar (VO) – Emissão de sons não agonísticos, incluindo a vocalização gutural.
Agonístico
Subcategoria que relaciona os tipos de comportamentos que envolveram algum tipo de luta ou conflito. Incluiu comportamentos de ameaça, defesa.
47. Brigar (BG) – Interagir com o outro animal; fortes patadas, arranhões e mordidas.
48. Deslocar o outro (DS) – Afastar outro animal a partir de vocalização agressiva.
49. Ser deslocado (SD) – Fugir do animal que lhe emitiu vocalização agressiva.
50. Rosnar (VR) – Postura com a cabeça direcionada ao outro animal com dentes a mostra; boca semi-aberta; lábios e orelhas puxadas para trás, acompanhada de som emitido do fundo da cavidade oral.
51. Morder o outro (MO) – Ato de comprimir entre os dentes alguma parte do outro animal.
52. Perseguir (PE) – Correr atrás do outro animal.
53. Ser perseguido (SP) – Diante de uma afronta potencial um animal foge de quem o persegue.
Cortejo
Inclui os comportamentos de corte e cópula.
54. Agarrar (AG) – Segurar outro animal, imobilizando-o.
55. Carregar o outro (CG) – O macho com a boca segura a fêmea pelo pescoço, arrastando- a pelo recinto, acompanhado, ou não, de vocalização tipo rosnar da fêmea enquanto é carregada (Figura 01).
57. Tentar cópula (TC) – Postura de monta, não acompanhada de movimentos copulatórios.
58. Cópula completa (COP) – Cópula com movimentos copulatórios e ejaculação.
Diferenciação entre os gêneros
Comportamentos Individuais. A Figura 1 mostra a freqüência de cada um dos padrões comportamentais desta categoria. Os comportamentos espirrar, tossir, molhar-se e urinar sobre não foram incluídos nas análises por terem ocorrido fora do período das observações sistemáticas. Enquanto para a fêmea o maior índice foi para o comportamento descansar (n=230), para o macho foi pacing (n=268). Os padrões menos representativos, com um único evento observado (n=1), foram Cavar e Chacoalhar para o macho e Espreguiçar, Carregar Comida e Forragear para a fêmea.
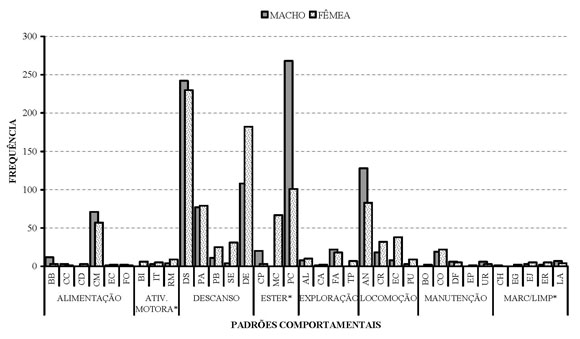
Figura 1. Freqüência dos comportamentos da Categoria Individual de um casal de papa mel no PEDI em 2005. (Ver no texto o significado das siglas).
Alimentação. O maior índice foi para o padrão comer, com n=71 e n=57 para o macho e para a fêmea, respectivamente. Nos momentos de fornecimento da alimentação, logo que o tratador colocava a primeira das duas bandejas, a fêmea arrastava-a para o lado e começava a se alimentar. Desse modo, o comportamento de carregar comedouro foi exclusivo dela. Tanto fêmea como macho se alimentaram de imediato da carne bovina e no decorrer do dia, das frutas. O comportamento de esconder comida foi observado apenas com carne, que em geral era enterrada ou escondida nas tocas. O comportamento caçar foi incorporado ao etograma após ter sido observado, uma única vez, em setembro de 2005, por volta das 11:00h. No início da observação deste dia, a fêmea foi vista posicionada acima de sua toca preferida, alimentando-se de um roedor, item não fornecido pelo zoológico como parte da dieta. A presa só foi retirada à força pelo tratador, após longa perseguição, seguindo orientação do veterinário do zôo, e foi descartado por se encontrar sem o crânio. Provavelmente a captura desta presa ocorreu no período noturno, quando a maioria dos roedores está em atividade, e foi consumida a partir da cabeça ao longo da manhã.
Estereotipias. Os comportamentos desta subcategoria foram mais exibidos pelo macho. Os padrões pacing e coprofogia foram superiores nele (n=268 e n=20) se comparado com os valores alcançados pela fêmea (n=101 e n=3, respectivamente). Já o comportamento mastigar capim foi registrado, em 67 eventos, apenas para a fêmea. Os animais exibiam estes comportamentos com maior freqüência no horário da manhã, antes da alimentação. O comportamento pacing teve sua intensidade aumentada quanto mais se aproximava o horário da alimentação. Durante este período macho e fêmea se distinguiram nos padrões – o macho exibia pacing ininterruptamente e a fêmea, apesar de eventualmente exibir pacing, se envolvia em atividades de deslocamento pelo recinto, mastigar capim e, inclusive, descansar.
Manutenção. Nesta subcategoria o comportamento que alcançou as mais altas freqüências foi coçar, tanto para a fêmea (n=22) quanto para o macho (n=19). O comportamento molhar-se foi observado na fêmea, por duas vezes em uma única tarde de alta insolação. Para os comportamentos de urinar e defecar cada membro do casal de papa mel apresentava seu local específico, próximos às paredes do recinto.
Atividade Motora. Os comportamentos desta subcategoria foram mais exibidos pela fêmea. O comportamento de “raspar/morder” mesmo sendo mais freqüente na fêmea (n=9), foi o padrão mais exibido pelo macho n=4. O comportamento brincar foi observado exclusivamente pela fêmea, que interagiu com diversos objetos que se encontravam no recinto. A fêmea mostrou-se sempre mais curiosa que o macho em relação a qualquer objeto do recinto.
Em agosto de 2005, foi feita uma tentativa, por parte dos técnicos do zoológico, de ambientação do recinto. Foram plantadas três mudas com cerca de 60 cm. O macho apenas farejou as plantas e se afastou. A fêmea, ao contrário, farejou, mordeu e arrancou as três mudas. As folhas e galhos espalhados serviram como brinquedos que ela carregava de um lado para outro, jogava e corria para pegar. A vegetação recém plantada no recinto durou apenas 30mim. Esse mesmo tipo de interação foi realizado com o comedouro, quando este se encontrava vazio. Em relação à interação com o tratador observou-se que teve sempre um caráter afiliativo, não sendo observada investida agonística em direção a ele.
Marcação/Limpeza. Nesta categoria a maior freqüência para o macho foi o comportamento de lamber (n=7), enquanto para a fêmea foi esfregar rosto e espojar-se, (ambos com n=5). O comportamento de lamber, apresentado pelo macho, além de representar o hábito de lamber partes de seu próprio corpo, era exibido com maior freqüência nos locais onde a fêmea havia urinado anteriormente. Para a fêmea, esfregar rosto era realizado geralmente após a alimentação, com o intuito de se livrar de restos de comida, sendo também registrado após a cópula, e interpretado como um modo de se livrar do cheiro ou secreção do macho que, no contexto pré-cópulatório, carrega segurando-a pelo pescoço. A Figura 02 mostra freqüências reduzidas de todos estes padrões, apesar de serem indicadores importantes de comportamentos característicos da espécie. Nesta figura não consta o padrão de urinar sobre, executado exclusivamente pelo macho.
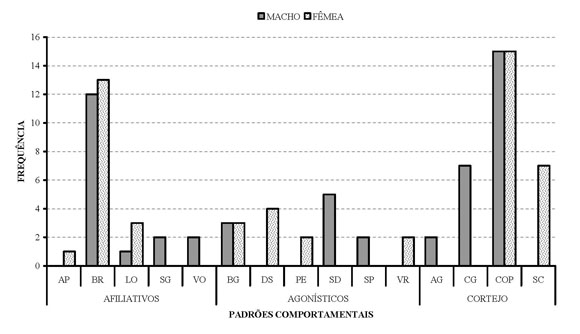
Figura 2. Freqüência dos comportamentos da Categoria Social de um casal de papa mel no PEDI em 2005. (Ver no texto o significado das siglas).
Exploração. Ambos os gêneros apresentaram maior freqüência para “farejar” (n=22 para o macho e n=18 para a fêmea). Porém, por ter sido exclusivo da fêmea (n=7), o comportamento de tentar pegar merece destaque. Ela esticava a pata anterior para fora do recinto e tentava alcançar e trazer para dentro galhos, folhas, mangueiras ou qualquer outro objeto que se encontrasse próximo à grade. Quando conseguia, o objeto era usado para brincar, ser guardado dentro de uma das tocas ou, simplesmente, esquecido.
Locomoção. Macho e fêmea apresentam padrões similares, porém a fêmea se destacou naqueles padrões que denotaram maior atividade física e uso mais amplo do espaço do recinto. Esta maior mobilidade no recinto, somada à habilidade de escalar (38 eventos na fêmea contra oito eventos no macho), se refletiu no fato de ela ter realizado uma fuga que culminou em seu resgate no recinto das raposas (Cerdocyon thous), tendo para isso ultrapassado o recinto do gato do mato (Leopardus tigrinus), localizado do lado esquerdo de seu recinto de origem.
Descanso. Nesta subcategoria o maior índice foi obtido pelo comportamento “descansar” (n=242 para o macho e n=230 para a fêmea). Nenhum outro comportamento teve, por parte da fêmea, um valor tão alto. Maiores diferenças entre os gêneros foram obtidas para deitar (n=182 para a fêmea e n=108 para o macho). Efeitos do sexo foram evidenciados também na preferência dos locais de descanso. Das três tocas disponíveis, a fêmea utilizou a toca central ou deitou-se na grama da parte frontal do recinto, próximo ao comedouro. O macho, em contraste, utilizou preferencialmente a primeira toca e o parapeito para estas atividades.
Comportamentos Sociais. A Figura 2 mostra a frequência de cada um dos comportamentos sociais apresentados pelos animais. Entre 18 padrões sociais as maiores freqüências, tanto para a fêmea quanto para o macho, foram obtidas para o comportamento de cópula (Subcategoria Cortejo) com n=15, seguido pelo comportamento de brincar (Subcategoria Afiliativa). Como comportamentos menos representativos, com apenas um evento registrado, encontraram-se lamber o outro para o macho e aproximar-se do outro para a fêmea. (ambos da Subcategoria Afiliativa). Os comportamentos coçar o outro, morder o outro, tentar cópula não foram incluídos nas análises por terem sido exibidos exclusivamente no período de construção do etograma ou nos intervalos da varredura instantânea.
Afiliativo. O padrão comportamental mais exibido pelos animais nesta subcategoria foi brincar com o outro, com n=12 para o macho e n=13 para a fêmea. Esta pequena diferença representa a não resposta do macho em uma das investidas da fêmea.
Quanto ao comportamento de lamber o outro, a fêmea apresentou uma porcentagem esperadamente maior, uma vez que executou este padrão em relação a ambos os machos.
Apenas a fêmea exibiu “aproximar-se do outro”, enquanto foram exibidos exclusivamente pelo macho os padrões “seguir o outro” (fora do contexto de cópula) e “vocalizar”.
Agonístico. Como esperado para uma espécie que é vista quase sempre aos pares em vida livre, o total de padrões comportamentais (sete) da subcategoria Agonística foi considerado baixo. O comportamento de brigar foi o único observado para os dois animais (n= 3). Padrões interdependentes como deslocar (n=4) e ser deslocado (n=5) e perseguir, (n=2) e ser perseguido (n=2), foram sempre iniciados pela fêmea. O comportamento de rosnar durante a varredura foi exibido apenas pela fêmea (n=2), e o padrão morder o outro foi observado uma única vez, durante a confecção do etograma. Em alguns casos, contextos de brigar ou brincar se confundiam e eram de difícil interpretação, como em momentos que a fêmea se aproximava apressadamente do macho, quando o mesmo estava distraído ou até dormindo, e empurrava-o rapidamente, afastando-se, sem motivo aparente.
Cortejo. Nesta subcategoria foram descritos padrões nunca anteriormente observados para a espécie, e incluiu a cópula, que alcançou a maior freqüência dentre todos os comportamentos da categoria social. Ao todo cinco comportamentos foram executados pelo casal. Destes agarrar e carregar o outro foram exibidos exclusivamento pelo macho. O comportamento de ser carregada (n=7) foi exclusivo da fêmea. O padrão tentar cópula foi observado nos intervalos de varredura e, portanto, não foi alvo de quantificação.
Durante períodos evidentes de cio, a fêmea demonstrou certa rejeição ao Macho I, e uma receptividade maior ao Macho II nos poucos momentos em que coincidiram nas varreduras instantâneas, a fase de cio e a soltura do mesmo. Estes eventos ocorreram em ocasiões de limpeza do cambiamento, em que o Macho II tentou montar a fêmea e esta não exibiu nenhum comportamento agonístico em resposta. Antes das tentativas de cópula iniciadas pelo Macho I sempre foram exibidos comportamentos agonísticos por parte da fêmea, como rosnar, deslocar o outro e brigar. Estes ocorriam enquanto o Macho I tentava agarrá-la pelo pescoço para, em seguida, executar a tentativa de cópula ou a cópula propriamente dita.
Nas vezes em que conseguiu segurar a fêmea pelo pescoço, o macho a carregou pelo recinto por, no máximo, três minutos. Isto ocorreu porque a fêmea, estando em desvantagem física, aparentemente relutava em copular. Este conjunto de padrões comportamentais, sempre exibidos em uma seqüência, foi considerado no presente estudo como parte natural da fase pré-copulatória ou corte típica dessa espécie.
Durante o trabalho, após a fase considerada como corte, foram observados três momentos de cópula, ocorridos nos meses de abril, agosto e novembro. Estes dados fornecem um indicativo da duração do ciclo estral e da idade da fêmea.
Discussão
Não foram encontrados na literatura científica estudos etológicos que tivessem como foco principal a espécie Eira barbara em ambiente natural. Informações ecológicas sobre ela são oportunísticas e relatam casos de interações com outras espécies de mamíferos, particularmente primatas (Asensio & Gómez-Marín, 2002; Bezerra, Barnett, Souto, & Jones, 2009; Camargo & Ferrari, 2007; Defler, 1980; Ferrari & Ferrari, 1990; Galef, Mittermeier, & Bailey, 1976; Moynihan, 1970). Nestes eventos anedotais o papa mel é observado solitário ou aos pares, atuando via de regra como presa ou predador. Em cativeiro uma ampla revisão realizada por Audet (1998), compila dados de campo e de cativeiro e inclui um estudo etológico de curta duração sobre um casal de Eira barbara no zoológico de Washington. O enriquecimento ambiental é o enfoque predominante neste estudo, assim como nos poucos estudos em cativeiro ainda não publicados, realizados no Brasil, porém disponíveis na internet.
Animais em cativeiro costumam desenvolver comportamentos que ou não fazem parte de seu repertório natural ou exibem uma freqüência acima àquela considerada normal. Algumas vezes zoológicos introduzem estressores não naturais aos animais, como as restrições espaciais e sociais, e, para algumas espécies a simples exposição aos visitantes e seus comportamentos já representam um fator de estresse. Outro fator pode ser a proximidade de outros animais potencialmente competidores ou predadores que, mesmo fora do campo de visão, podem ser percebidos por senhas odoríferas, auditivas entre outros sensores. Pode-se argumentar que alguns comportamentos têm sido observados em situações estressantes também na natureza, porém a preocupação nos zoológicos é que um comportamento anormal torne-se uma estereotipia (Drazilová, 2006).
Nossos dados revelam que estereotipias impostas pelo cativeiro pareceram afetar mais o macho que a fêmea. Neste estudo, se categorizou como estereotipias coprofagia, pacing e mastigar capim. A coprofagia exibida por ambos os sexos, mas altamente predominante no macho, também foi observada em um estudo de enriquecimento ambiental de um casal de papa mel, mantido no Zoológico de Brasília (Fernandes & Bocchigliere, 2005). Coprofagia e pacing foram exibidos pelo macho em uma freqüência total muito superior ao da fêmea. Conforme descrito nos resultados o pacing foi exibido em associação ao movimento bamboleante da cabeça (head swing) em cada mudança de direção, conforme foi também observado para Canis dingo (Mason, 1991a). A diferença entre gêneros desse padrão associado ao horário da alimentação também foi observada por Audet (1998). O pacing executado pelos animais do presente estudo no parapeito do recinto, ou próximo à porta de entrada do mesmo, foi exibido com maior freqüência no horário da manhã, antes da alimentação. Esta mesma relação entre pacing e alimentação foi observada para um outro carnívoro, a jaguatirica, em cativeiro (Weller & Bennett, 2001). O comportamento de mastigar capim foi exibido, predominantemente pela fêmea em contexto associado com a alimentação, porém quase sempre era seguido pelo padrão descanso. As poucas observações desse padrão no macho ocorreram fora do período de varredura, por isso não foram incluídas nas análises. Não há relato deste padrão na literatura, apesar de ser comum o uso de capim como cobertura do solo em recintos. Em revisão sobre estereotipias Mason (1991b) destaca que alguns padrões parecem sofrer reforço positivo por ter conseqüências benéficas para o animal. Este padrão pareceu promover uma forma de relaxamento nos momentos de ânsia que antecediam o fornecimento da alimentação, visto que foi frequentemente seguido de descanso.
Entre todos os comportamentos exibidos no cativeiro os relacionados à alimentação são os maiores alvos de atenção das ações e programas de enriquecimento. Um casal de papa mel foi alvo de estudos de enriquecimento alimentar (Fernandes & Bocchiglieri, 2005) na Fundação Jardim Zoológico de Brasília. Diferentemente do casal estudado por Audet (1998) no National Zoological Park (NZP) em Washigton, D.C. nos Estados Unidos, o manejo alimentar do casal mantido no PEDI não incluía pintos e camundongos inteiros mortos. No início de um dos dias das observações sistemáticas a fêmea do presente trabalho foi vista, em cima de sua toca preferida, se alimentando de um rato de cor cinza, que se encontrava sem a cabeça, o que impediu sua identificação. No NZP, apesar da ausência de observações de caça ou morte de presas vivas (Audet, 1998) carcaças sem a cabeça de esquilos e aves nativas eram eventualmente encontradas no recinto ou nas tocas pelos tratadores, durante a limpeza dos recintos, pois macho e fêmea foram mantidos separados, a maior parte do tempo do estudo. Este mesmo modo de se alimentar foi relatado para cativeiro, por doninhas Ictonyx striatus (Larivière, 2002 da mesma subfamília - Mustelinae - do papa mel); e por civetas Civettictis civetta (Ewer & Wemmer, 1974 da mesma ordem Carnivora, subordem Feliformia, família Viverridae), que carregavam a maioria das presas para a caixa ninho (toca) e a consumiam a partir da cabeça. Estes relatos indicam que este modo de alimentação é representativo de diferentes famílias, de corpo alongado e pernas curtas (short dog-like form), da ordem Carnivora.
O casal do NZP (Audet, 1998) exibiu um outro padrão alimentar comum ao casal do presente trabalho. Ambos os sexos carregaram seus alimentos preferidos para a toca, e os esconderam cobrindo com feno ou folhas secas (NZP) ou cavando o solo desnudo do recinto e enterrando-os (PEDI).
Quanto aos comportamentos de Manutenção a ocorrência de um dos padrões, no entanto, deve ser ressaltada uma vez que os dados do presente estudo vão de encontro aos da literatura. Kaufmann e Kaufmann (1965) relataram que, apesar de terem os dedos das patas parcialmente interligados (Pocock, 1921), os indivíduos em cativeiro evitavam entrar na água, porém em vida livre poderiam nadar bem (Nowak, 2005). Contudo, como descrito anteriormente, a fêmea foi vista entrando e se deitando dentro da bandeja com água, sem outro motivo aparente que não se refrescar. Apesar de nunca se demorar, só a fêmea do casal estudado no NZP por Audet (1998) entrou deliberadamente na piscina de seu recinto, em clara concordância com os dados obtidos no presente estudo.
Para os comportamentos de urinar (UR) e defecar (DF) o casal de papa mel segue o padrão de outros mustelídeos em cativeiro, apresentando locais específicos para defecar, como o furão americano Galictis vittata, que urina e defeca sempre no mesmo local (Yensen & Tarifa, 2003), e a doninha africana Poecilogale albinucha, que geralmente defeca contra uma parede vertical (Larivière, 2001).
Para a subcategoria de Atividade Motora, o comportamento brincar (BI) foi observado apenas na fêmea, que costumava interagir com objetos que se encontravam no recinto ou fora, mas ao alcance de suas patas. Nowak (2005) confirmou este padrão para o papa mel, afirmando que em cativeiro a espécie demonstra prazer em se engendrar em brincadeiras e concluindo que ela poderia, assim, ser passível de domesticação.
Cazes (1995) insiste que, apesar de ser muito difícil manter plantas nos recintos, devido a destruição por parte de alguns animais, é importante que elas sejam substituídas imediatamente. Na opinião deste autor as plantas possuem uma função importante, pois além de criar um micro clima apropriado, fornecem uma atmosfera mais autêntica tanto para o animal como para o visitante. Demonstrando manipular ativamente o ambiente físico, a fêmea destruiu tão rapidamente as plantas utilizadas com freqüência pelos técnicos do zoológico, nas tentativas de ambientação do recinto, que impediu qualquer avaliação de mudança no conforto físico dos animais, resultante da amenização do calor, ou da existência de nichos que pudessem atuar com pontos de fuga para eles.
Não se encontrou na literatura relatos de acidentes graves entre papa mel e tratador, porém a Instrução Normativa Nº 04/2002 do IBAMA (BRASIL, 2006) classifica o recinto do papa mel como Nível de Segurança II, ou seja, faz-se necessária a contenção física do animal antes da entrada do tratador no mesmo. Este manejo obrigatório não foi seguido ao longo de toda coleta de dados. As interações com o tratador pela sua relevância no repertório do casal observado foram incluídas na subcategoria Atividade Motora. Estas interações eram livres de tensões por ambas as partes envolvidas. A aptidão para escalada dessa espécie enfatizada por Nowak (2005), e a predisposição para fuga presente na maioria dos animais silvestres quando em situação de cativeiro, associada à maior mobilidade da fêmea, pode ser a base da explicação de sua fuga do recinto.
Corroborando com os dados de Audet (1998) o casal de papa mel exibiu o padrão farejar (subcategoria Exploração), independente do sexo e, no caso do presente estudo, em alta porcentagem. Nos dois estudos a exibição desse padrão se intensificava quando ruídos e/ou movimentos inusitados ocorriam. Segundo Defler (1980) a visão do papa mel é relativamente pobre e o sentido mais aguçado nos momentos de forrageio é o olfato, considerado por ele o primeiro método de detecção de presas. O que motivou a reação do animal a este tipo de estímulo, no entanto, normalmente passa despercebido do limitado equipamento olfativo do observador, levando-o, ocasionalmente, a interpretá-lo como que ocorrendo no vazio.
Cópulas observadas no presente trabalho ocorreram nos meses de abril, agosto e novembro, revelando fortes indícios sobre a idade da fêmea, através da duração do ciclo estral. Em um monitoramento reprodutivo realizado por Poglayen-Neuwall, Durrant, Swansen, Williams e Barnes (1989), o ciclo estral foi de 52.2 ± 15.5 dias em fêmeas jovens e 93.9 ± 21.0 dias em fêmeas mais velhas. Neste estudo o cálculo do intervalo entre as fases do ciclo estral da fêmea resultou em 103 dias entre as primeiras, e 88 dias entre as últimas cópulas observadas, o que resulta um ciclo médio de 95,5 dias, padrão típico de fêmeas mais velhas. Estas inferências quanto à idade da fêmea foram corroboradas com os dados fornecidos pelo zoológico. A fêmea chegou já adulta no ano de 1998. Informações de que fêmeas podem entrar em ciclo estral várias vezes a cada ano, podendo manter-se receptiva por períodos de 03 a 20 dias (Poglayen-Neuwall, 1975), concordam com os dados obtidos no presente estudo. Em conformidade com os dados de Presley (2000) que relatou, em cativeiro, a ocorrência em plena luz do dia, de atividades de cópula e interações sociais entre indivíduos adultos, as observações de cópula do presente trabalho também ocorreram pela manhã. Ferrets domésticos (Mustela putorius, Mustelidae) têm o comportamento reprodutivo bem definido (Bays, Lightfoot, & Mayer, 2009), que se assemelha ao do papa mel, em muitos aspectos exceto no padrão carregar o outro. Muitos eventos de cópula do papa mel foram observados no cativeiro e relatados na literatura (Poglayen-Neuwall, 1975; Poglayen-Neuwall et al., 1989; Presley, 2000), no entanto, em nenhum deles há menção de padrãos pré-copulatórios típicos de uma corte, como a que foi observada nos três períodos de estro da fêmea e nas cópulas com ambos os machos que dividiam com ela o recinto. A possibilidade de que a seqüência de eventos aqui classificada como corte fosse um artefato de cativeiro, foi descartada por três motivos: 1. a origem silvestre dos animais que já chegaram adultos ao cativeiro; 2. o padrão de interação da fêmea com ambos os machos; e 3. a seqüência padronizada seguida de modo idêntico nos três períodos de estro observados. A clara resistência da fêmea ao macho I, com o qual passava a maior parte do tempo e sua evidente preferência pelo macho II, cujo contato se restringia aos momentos de limpeza do recinto, levanta questões relativas ao manejo adequado ao caso do zoológico ter interesse na reprodução dessa espécie.
O melhor conhecimento dos padrões comportamentais dessa espécie e os efeitos do sexo na expressão de seu repertório precisam ser utilizados para a melhoria das condições de manejo e bem estar da espécie. Das várias sugestões possíveis duas se sobressaem e suportam a quebra da regularidade, às vezes sinônimo de monotonia, do manejo em cativeiro, nos aspectos do oferecimento de alimento e da junção do casal. Catapulta que dispara comida no recinto em intervalos aleatórios tem reduzido muito os comportamentos estereotipados em lontras (Gothard, 2007) e encontros ocasionais e junções do casal restritas ao período de cio, podem ser efetivos na reprodução de Eira barbara mantida no PEDI.
Eira barbara em cativeiro apresentou um amplo repertório comportamental, acrescido de padrões estereotipados, que inexistem ou são raramente emitidos no ambiente natural, resultantes de inadequações no manejo;
Como observado na maioria dos estudos de cativeiro, o pacing foi a estereotipia mais comumente exibida pelo casal de papa mel. Diferente da coprofagia, o padrão comer capim trouxe conseqüências benéficas que reforçaram seu desempenho;
Mitigação ou supressão de estereotipias que afetam negativamente o bem estar dos animais, poderá ocorrer com o desenvolvimento de um programa sistemático de enriquecimento ambiental associado à alimentação;
A fêmea copulou com ambos os machos, oferecendo menor resistência ao macho que esteve a maior parte do tempo no cambiamento, sem contato físico, mas com contato visual. Intervalos entre os períodos de estros e comportamentos de cópula estão de acordo com a literatura;
Corte ritualizada é, pela primeira vez, descrita e fundamentos são apresentados para justificá-la como parte do repertório habitual da espécie, e não como um artefato de cativeiro;
Dos 58 padrões descritos ao longo do estudo, quatro foram exibidos exclusivamente pelo macho, e o dobro foi exclusivo da fêmea, que se mostrou mais ativa.
Referências
Asensio, N., & Gómez-Marín, F. (2002) Interspecific interaction and predator avoidance behavior in response to tayra (Eira barbara) by mantled howler monkeys (Alouatta palliata ). Primates, 43, 339-341 [ Links ]
Audet, A. M. (1998) Behavior of the tayra, Eira barbara (Carnivora: Mustelidae) in captivity. Zoologische Garten, 68, 300-320. [ Links ]
Bays, T. B., Lightfoot, T., & Mayer, J. (2009). Comportamento de animais exóticos de companhia: aves, répteis e mamíferos de pequeno porte (S. N. Vitaliano & C. Filoni, trads.). São Paulo: Roca. [ Links ]
Bezerra, B. M., Barnett, A. A., Souto, A., & Jones, G. (2009). Predation by the tayra on the common marmoset and the pale-throated three-toed sloth. Journal of Ethology, 27, 91-96. [ Links ]
Brasil. (2002, 04 de março). Instrução Normativa nº 04, de 04 de março de 2002. Estabelece critérios de manutenção para jardins zoológicos. Diário Oficial da União, Brasília, DF. Recuperado em 09 de junho de 2006, de http://www.ibama.gov.br/fauna/legislação/in_04_02.pdf [ Links ]
Bulbeck, C. (2005). Facing the wild: Ecotourism, conservation & animal encounters. London: Earthscan. [ Links ]
Cazes, V. L. F. (1995). Concepção de recintos - zôo arquitetura uma intervenção necessária. In Sociedade de Zoológicos do Brasil (Org.), Arquivos da SZB (pp. 78-81). Sorocaba, SP: Sociedade de Zoológicos do Brasil. [ Links ]
Camargo, C. C., & Ferrari, S. F. (2007). Interactions between tayras (Eira barbara) and red-handed howlers (Alouatta belzebul) in eastern Amazonia. Primates, 48, 147-150. [ Links ]
Defler, T. R. (1980). Notes on interactions between tayra (Eira barbara) and the white-fronted capuchin (Cebus albifrons). Journal of Mammalogy, 61, 156. [ Links ]
Drazilová, D. W. (2006). Zoo animal welfare. Journal of Agricultural and Environmental Ethics, 9, 27–36. [ Links ]
Emmons, L. H., & Feer, F. (1990). Neotropical rainforest mammals: A field guide. Chicago: The University of Chicago Press. [ Links ]
Ewer, R. F., & Wemmer, C. (1974). The behaviour in captivity of the African civet, Civettictis civetta (Schreber, 1776). Zeitschrift für Tierpsychologie, 34, 359-394. [ Links ]
Fernandes, H., & Bocchigliere, A. (2005) Enriquecimento ambiental para iraras (Eira barbara) no Jardim Zoológico de Brasília. In Livro de Resumos, III Congresso Brasileiro de Mastozoologia: Diversidade e Conservação de Mamíferos (p. 39). Vitória: Sociedade Brasileira de Mastozoologia. [ Links ]
Ferrari, S. F., & Lopes Ferrari, M. A. (1990) Predation avoidance behaviour in buffy-headed marmoset, Callithrix flaviceps. Primates, 31, 323–338. [ Links ]
Galef, B. G. Jr., Mittermeier, R. A., & Bailey, R. C. (1976). Predation by the Tayra (Eira barbara). Journal of Mammalogy, 57, 760-761. [ Links ]
Gothard, N. (2007) What is the proximate cause of begging behaviour in a group of captive asian short-clawed otters? IUCN Otter Specialist Group Bulletin, 24(1), 14-35. [ Links ]
Kaufmann J. H., & Kaufmann, A. K. (1965). Observations of the behavior of tayras and grisons. Zeitschrift für Saügertierkunde, 30, 146–155. [ Links ]
Larivière, S. (2001). Poecilogale albinucha. Mammalian Species, 681, 1-4. [ Links ]
Larivière, S. (2002). Ictonyx striatus. Mammalian Species, 698, 1-5. [ Links ]
Mason, G. J. (1991a). Stereotypies and suffering. Behavioural Processes, 25, 103-115. [ Links ]
Mason, G. J. (1991b). Stereotypies: A critical review. Animal Behaviour, 41, 1015-1037. [ Links ]
Moynihan, M. (1970) Some behavioral patterns of platyrrine monkeys. II. Saguinus geoffroyi and some other tamarins. Smithsonian Contributions to Zoology, 28, 1-77. [ Links ]
Nowak, R. M. (2005). Walkers carnivores of the world. Baltimore: The Johns Hopkins University Press. [ Links ]
Peixoto, K. E. V. S. (1998) Comportamento social dos Quatis (Nasua nasua, Procyonidae). Dissertação de Mestrado, Universidade Federal da Paraíba, João Pessoa. [ Links ]
Pitsko, L. E. (2003). Wild Tigers in Captivity: A Study of the Effects of the Captive Environment on Tiger Behavior. Dissertação de Mestrado, Virginia Polytechnic Institute and State University, Blacksburg, VA. [ Links ]
Pocock, R. I. (1921). On the external characters and classification of the Mustelidae. Proceedings of the Zoological Society of London, p 803-837. [ Links ]
Poglayen-Neuwall, I. (1975). Copulatory behavior, gestation and parturition of the tayra (Eira barbara L., 1758). Zeitschrift für Saügertierkunde, 40, 176–189. [ Links ]
Poglayen-Neuwall, I., Durrant, B. S., Swansen, M. L., Williams, R. C., & Barnes, R. A. (1989). Estrous cycle of the tayra, Eira barbara. Zoo Biology, 8, 171–177 [ Links ]
Presley, S. J. (2000). Eira barbara. Mammalian Species, 636, 1-6. [ Links ]
Reid, F. A. (1998). A field guide to the mammals of Central America and Southeastern Mexico. Oxford: Oxford University Press. [ Links ]
Weber, A., & Rezende, S. M. (1998). Reserva ecológica e Parque Dois Irmãos: histórico e situação atual. In I. C. Machado, A. V. Lopes, & K. C. Porto (Orgs), Reserva ecológica de Dois Irmãos: estudos em um remanescente de Mata Atlântica em área urbana (Recife - Pernambuco - Brasil) (pp. 9-18). Recife: Editora Universitária da UFPE. [ Links ]
Weller S. H., & Bennett C. L. (2001). Twenty-four hour activity budgets and patterns of behavior in captive ocelots (Leopardus pardalis). Applied Animal Behaviour Science, 71, 67 - 79. [ Links ]
Yensen, E., & Tarifa, T. (2003). Galictis vittata. Mammalian Species, 727, 1-8. [ Links ]
Recebido em: 3/03/2009
Aceito em: 20/09/2009
Autor para correspondência: Maria Adélia Borstelmann de Oliveira, Universidade Federal Rural de Pernambuco (UFRPE), Departamento de Morfologia e Fisiologia Animal (DMFA), Rua Dom Manoel de Medeiros, s/nº Dois Irmãos. CEP: 52.171-900 Recife/PE. E-mail: adelia@dmfa.ufrpe.br
* Agradecimentos: À equipe administrativa, veterinários e tratadores do PEDI por terem permitido e ajudado na realização da pesquisa. A Siobhan Carmody pela tradução do abstract. Aos colegas de laboratório e a todos que de alguma forma contribuíram com vídeos, imagens, e pitacos.














