Serviços Personalizados
Journal
artigo
Indicadores
Compartilhar
Revista de Etologia
versão impressa ISSN 1517-2805versão On-line ISSN 2175-3636
Rev. etol. v.8 n.1 São Paulo jun. 2006
ARTIGOS
Comportamento a rufiação de éguas mestiças submetidas a diferentes protocolos de sincronização de cio
Sexual behavior during teasing of crossbreeds mares under different protocols of estrous synchronization
Carmem Estefânia Serra Neto Zúccari, Felipe Alan Laxe de Paula, Camila da Silva Ferreira, Daniela Brandão Nunes, Eliane Vianna da Costa e Silva
Faculdade de Medicina Veterinária e Zootecnia, UFMS
ABSTRACT
Twenty-one mares were assigned to three treatments: Group 1 - prostaglandin F2α (PGF2α); Group 2 - progesterone in oil plus PGF2α and; Group 3 - CIDR device and PGF2α. The sexual behavior was observed during teasing for at least 180 seconds. The sexual behavior of mares quantified were: held ears back (HEB), switched tail (ST), diestrus vocalization (DV), kicked (K), raised tail (RT), winked clitoris (WC), urinated (U), estrus vocalization (EV), immobile while being mounted (IM), posturing (P). During estrus was difference (p<0.05) between mares in relation to K, RT, and WC; during diestrus for HEB, ST, DV, K and WC (p<0.05). There were difference for EV (p<0.05) between Groups2 and 3>Group1, and at diestrus differences for ST between Groups2 and 3
Keywords: Estrous synchronization, Mare, Sexual behavior, Teasing
RESUMO
Para estudar o comportamento a rufiação, frente a diferentes protocolos de sincronização de cio, 21 éguas foram submetidas a três tratamentos: prostaglandina F2α (PGF2α); progesterona oleosa + PGF2α e; CIDR® + PGF2α. A rufiação foi feita pela exposição ao macho por 180 segundos, acrescida de 120 segundos se a égua não se mostrasse reativa. Variáveis comportamentais avaliadas: murchar orelhas (MO), agitar cauda (AC), vocalização diestro (VcD), escoicear (ESC), levantar cauda (LC), eversão clitóris (EC), micção (MIC), vocalização estro (VcE), imobilidade a monta (IMOB) e abertura membros posteriores (AMP). No cio houve variação entre éguas (p<0,05) para ESC, LC, EC e, no diestro para MO, AC, VcD, ESC e EC (p<0,05). A VcE diferiu entre P4-PG e CIDR®-PG > PG-PG. No diestro AC para P4-PG e CIDR®-PG < PG-PG e, para ESC, PG-PG > CIDR®-PG > P4-PG (p<0,05). Conclui-se que os tratamentos hormonais não alteraram as principais manifestações comportamentais a rufiação, devendo ser considerada a variação entre éguas.
Palavras-chave: Comportamento sexual, Rufiação, Sinconização de cio, Éguas.
Uma das maiores dificuldades encontradas para alcançar bons índices no manejo reprodutivo dos eqüinos é a grande variação na duração do cio, tanto entre indivíduos quanto entre ciclos de um mesmo animal (Ginther, 1992). A eficiência reprodutiva dos eqüinos depende da detecção correta do estro para que a monta natural ou inseminação artificial (IA) sejam feitas o mais próximo possível do momento da ovulação. O método mais indicado para a detecção do cio é a exposição individual das éguas a um macho sexualmente ativo, o rufião (Squires, 1993). As principais características comportamentais que demonstram a receptividade da égua no cio frente ao macho, em ordem decrescente de ocorrência, são a imobilidade e abertura dos membros posteriores, micção, eversão do clitóris e levantamento da cauda (Silva, Unanian, & Esteves, 1998).
O aumento e estabilização dos níveis plasmáticos dos esteróides gonadais podem ser considerados os fatores de ativação do sistema nervoso central que desencadeiam a motivação sexual. Os sinais de cio são exibidos após as concentrações periféricas de progesterona (P4) estarem abaixo de 2 ng/ml e as de estrógeno encontrarem-se em elevação (Ginther, 1992). Para a manipulação farmacológica do ciclo reprodutivo de éguas têm sido empregados progestágenos e/ou prostaglandina F2α (PGF2α), em especial na sincronização do cio de éguas cíclicas, buscando concentrar as atividades do manejo reprodutivo em curto período de tempo, ou, nos programas de transferência de embriões para a sincronização entre doadoras e receptoras. Alguns protocolos de sincronização utilizam a aplicação diária de P4 oleosa ou de seu derivado sintético ativo por via oral, por períodos de 8 a 14 dias (Squires, 1993). A PGF2α, quando aplicada em qualquer fase do ciclo estral, requer o uso de duas doses consecutivas, com intervalo de 14 a 15 dias entre elas (Irvine, 1993). Aparentemente, até o momento a literatura não dispõe de informações sobre o efeito da hormonioterapia sobre aspectos do comportamento sexual das éguas durante a detecção do estro. O objetivo do presente trabalho foi avaliar o efeito de diferentes protocolos de sincronização de cio, empregando PGF2α ou P4 associada à PGF2α, sobre as manifestações comportamentais do estro e/ou diestro durante a rufiação.
Materiais e Métodos
O experimento foi realizado durante os meses de fevereiro e março de 2005, na Fazenda Campanário, Município de Laguna Carapã – MS, utilizando 21 fêmeas virgens, mestiças Quarto de Milha, com idade entre 4 e 15 anos. O escore médio de condição corporal ao início do experimento foi igual a 6 (escala de 1 a 9; Henneke, Potter, Kreider,& Yeates, 1983). As éguas foram mantidas em piquete de Coast cross (Cynodon dactylon), com água e sal mineral ad libitum. Para a sincronização do cio as éguas (n = 7) foram aleatoriamente divididas em três tratamentos: Grupo 1 (PG-PG) - duas doses de PGF2α (5 mg de dinoprost trometamina - Lutalyse®), por via intramuscular (IM), sendo uma no dia zero (D0), início dos tratamentos, e outra no dia 15 (D15); Grupo 2 (P4-PG) - 200 mg de P4 oleosa, por via IM, do D0 a D9, com aplicação de PGF2α no D9 e; Grupo 3 (CIDR-PG) - dispositivo intravaginal contendo 1,9 g de P4 natural (CIDR® - Pfizer), inserido no D0 e removido no D10, com uma aplicação de PGF2α no D10. A rufiação individual diária foi realizada no decorrer dos tratamentos e até o término do cio, sempre no período da manhã. O tempo mínimo de exposição das éguas ao rufião foi de 180 segundos, podendo ser prolongado por mais 120 segundos de acordo com a reatividade da égua. Éguas e rufião eram controlados por cabresto, sendo a fêmea conduzida até o local da rufiação. A aproximação do macho era feita cabeça a cabeça e, após, direcionado para a região posterior da fêmea. As variáveis comportamentais avaliadas foram: murchar as orelhas (MO), agitar a cauda (AC), vocalização no diestro (VcD), escoicear (ESC), levantamento da cauda (LC), eversão do clitóris (EC), micção (MIC), vocalização no estro (VcE), imobilidade a monta (IMOB) e abertura dos membros posteriores (AMP), sendo registradas as freqüências dos eventos. Exames ultra-sonográficos transretais diários, com aparelho Aloka SSD 500 e transdutor linear de 5 MHz, foram realizados para o acompanhamento da dinâmica folicular, do início do experimento até seis dias após a ovulação. As comparações entre médias, dos comportamentos de estro e diestro, foram feitas pelo teste t de Student e, entre tratamentos, aplicando-se o teste de Student Newman Kewls (SNK), ambos em nível de 5% de significância, após transformação dos dados para raiz quadrada de x+1 (Sampaio, 1998).
Resultados e Discussão
As manifestações comportamentais médias das éguas para os períodos de estro e diestro, avaliadas durante a rufiação, são apresentadas na Tabela 1.
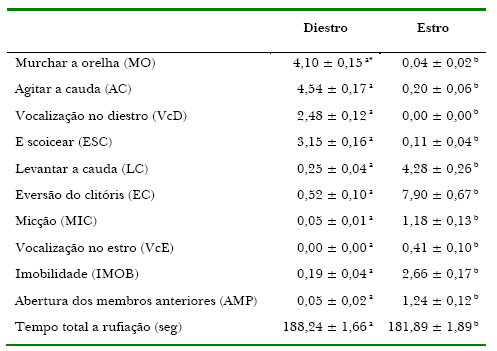
Tabela 1. Freqüência média geral dos comportamentos a rufiação de éguas submetidas a diferentes protocolos de sincronização de cio.
Os resultados obtidos estão de acordo com aqueles descritos por Back, Pickett, Voss, e Seidel (1974) em que a combinação mais efetiva de respostas durante o cio, que indicam uma probabilidade de 76 a 84% das éguas estarem em cio, é a eversão do clitóris, o levantamento de cauda, imobilidade e a abertura de membros. Os autores ressaltam a alta repetibilidade dos comportamentos apresentados pelo animal em diferentes anos, o que valida os resultados do presente trabalho mesmo diante do tamanho amostral utilizado. Embora, no presente trabalho, os sinais de estro não tenham sido expressos na mesma seqüência, observou-se a mesma combinação de eventos relatada por Ginther (1992) que, em descrição do comportamento ao cio da égua, apresentou a seguinte seqüência – levantar a cauda, eversão de clitóris, imobilidade e micção.
No que se refere a VcD esta foi mais freqüente que a VcE, resultado este compatível com o descrito por Ginther (1992), que detectou 66% das éguas vocalizando no diestro e 34% no estro, assim como a média de 2,48 vocalizações por período de exposição ao rufião no diestro, contra o valor médio de 0,41 vocalização por período no estro, observados no presente trabalho.
Pickerel, Crowell-Davis, Caudle, e Estep (1993) estudando a preferência sexual de éguas frente a diferentes garanhões, descreveram a ocorrência de EC (56%), LC (53%), MIC (35%), abaixar o posterior (33%) e vocalização da fêmea (7%), no estro. No presente trabalho as freqüências das principais manifestações comportamentais durante o estro foram a EC (7,90), LC (4,28), IMOB (2,66), AMP (1,24) e MIC (1,18), ou seja, a micção foi um evento de baixa ocorrência e a VcE foi a característica de menor incidência.
A rufiação isolada não é um método seguro para o acompanhamento da atividade cíclica, pois alterações do estro e diestro são comuns na espécie eqüina em especial nas fases de transição. A incidência de cios silenciosos varia de 7 a 9%, podendo chegar a 15% mesmo sob boas condições de manejo a rufiação, sendo considerado o aspecto psicológico como sua causa mais provável, em especial para as categorias de éguas virgens e paridas (Ginther, 1992). Após o término dos tratamentos, 85,7% (18/21) das éguas apresentaram sinais externos de cio, embora 100% tenham ovulado nos grupos PG-PG e P4-PG, o que corresponde a 14,3% de cios silenciosos. Apesar da idade média de 9,5 anos, todas as éguas eram virgens por pertencerem ao grupo de animais de trabalho da fazenda, uma das categorias que apresenta cios silenciosos. A idade das reprodutoras tem efeito sobre a fertilidade (Kurtz Filho et al., 1998), mas não sobre as características comportamentais a rufiação.
Enquanto os padrões de comportamento sexual apresentados pelas éguas têm alta repetibilidade em diferentes anos (Back et al., 1974), há grande variação na duração do cio, tanto entre indivíduos quanto entre ciclos de um mesmo animal (Ginther, 1992; Romano, Mucciolo, e Feliciano e Silva, 1998). Hughes, Stabenfeldt, e Evans (1972) encontraram duração média do estro de 4,75 dias referente ao mês de agosto (hemisfério norte), correspondendo ao mês de fevereiro para o hemisfério sul, durante estudo comparativo do estro eqüino nas diferentes épocas do ano. Essa duração média do estro se apresentou numericamente superior aos valores observados no presente trabalho, que para os grupos PG-PG, P4-PG e CIDR-PG foram de 3,44 ± 0,47, 4,00 ± 0,63 e 2,57 ± 0,69, respectivamente, não havendo diferença estatística entre os tratamentos (P = 0,28). Não eram esperados períodos tão curtos de cio considerando que na época do ano em que o experimento foi realizado já estava se aproximando a fase de transição para o anestro sazonal, quando os cios normalmente são mais longos e irregulares em razão do declínio funcional do eixo hipotalâmico-hipofisário-gonadal (Ginther, 1992). Apenas no grupo CIDR-PG uma égua apresentou folículo persistente por mais de 15 dias, possivelmente por estar na transição para o anestro estacional. Cios mais curtos são comuns na época do solstício de verão, quando o aumento do fotoperíodo atua positivamente sobre a foliculogênese, adiantando a ocorrência da ovulação (McKinnon & Voss, 1993). Contudo, devem ser considerados como fatores favoráveis para uma atividade cíclica regular a latitude (22°S) e a ótima condição corporal em que os animais se encontravam. Zúccari, Nunes, e Corrêa Filho (2002) trabalhando na mesma latitude, com éguas da raça Pantaneira, relataram para 147 ciclos analisados durante quatro estações de monta, uma duração média do estro de 6,63 ± 0,37 dias. Já, Romano et al. (1998) estudando a biologia reprodutiva de éguas mestiças de Puro Sangue Árabe observaram para estas uma duração do estro significativamente menor (5,42 ± 1,77 dias) que àquela das fêmeas Puro Sangue Árabe (9,82 ± 4,85 dias).
Houve variação entre éguas, durante o cio, para as seguintes variáveis: ESC, LC, EC pelo teste SNK (p<0,05). Da mesma forma, houve variação entre éguas, durante o diestro, para MO, AC, VcD, ESC e EC (p<0,05). Estas ocorrências demonstram a individualidade comportamental das éguas durante o estro e diestro, revelando a importância de se considerar o temperamento dos animais com que se trabalha ao se avaliar as atitudes durante a rufiação.
Quanto ao efeito dos tratamentos sobre as variáveis comportamentais do estro observou-se diferença significativa para VcE entre P4-PG e CIDR-PG em relação ao PG-PG, que apresentou a menor freqüência (Tabela 2). Já, os resultados de Wilde, De La Veja, e Cruz (2002), utilizando dispositivo intravaginal (PRID®) para a sincronização do estro de éguas da raça Peruana de Passo, demonstraram que ao final do tratamento 82% delas apresentaram sinais externos de cio, sendo estes considerados normais quanto à intensidade e duração, embora medidas específicas do comportamento a rufiação não tenham sido relatadas. Heldberg, Dalin, Ohagen, Holm, e Kindahl (2005) relatam que, ao analisarem se o estágio do ciclo estral das éguas interferia na resposta aos testes comportamentais utilizados para a avaliação do temperamento, não observaram diferenças entre os períodos de estro e diestro, concluindo que os mesmos podem ser aplicados em qualquer fase. Desta forma, pode-se supor que a causa da diferença encontrada no presente trabalho se deva a variação individual entre éguas e não ao efeito dos tratamentos hormonais.
Já, quanto ao diestro o evento AC dos grupos P4-PG e CIDR-PG foi inferior ao grupo PG-PG (p<0,05) e para ESC houve diferença significativa entre os três tratamentos (PG-PG > CIDR-PG > P4-PG; Tabela 2). Neste caso, supõe-se que a prostaglandina não tenha sido tão efetiva no bloqueio da agressividade característica do diestro, como parece ocorrer quando a progesterona é utilizada (Tabela 2).
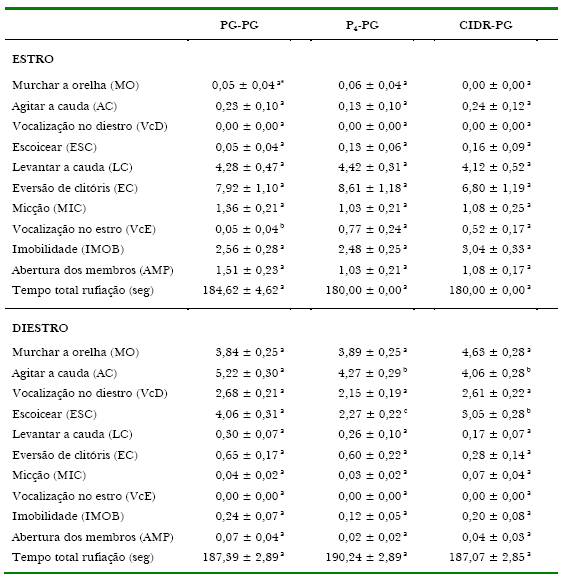
Tabela 2. Freqüência média dos comportamentos a rufiação de acordo com os tratamentos**.
Conclusões
De acordo com os resultados obtidos conclui-se que os tratamentos hormonais para a sincronização do cio empregando prostaglandina F2α ou prostaglandina F2α associada à progesterona, de modo geral, não alteraram as principais manifestações comportamentais das diferentes fases do ciclo estral de éguas, contudo, deve se levar em consideração a variação existente entre éguas quanto à freqüência e/ou ocorrência de alguns eventos comportamentais nas fases de estro e diestro.
Referências
Back, D. G., Pickett, B. W., Voss, J. L., & Seidel Jr., G. E. (1974). Observations on the sexual behaviour of nonlactanting mares. Journal of the American Veterinary Medical Association, 165, 717-720. [ Links ]
Ginther, O. J. (1992). Reproductive biology of the mare: Basic and applied aspects (2nd ed.). Madison: Equiservices. [ Links ]
Hedberg, Y., Dalin, A. M., Ohagen, P., Holm, K. R., & Kindahl H. (2005). Effect of oestrous-cycle stage on the response of mares in a novel object test and isolation test. Reproduction in Domestic Animals, 40, 480-488. [ Links ]
Henneke, D. R., Potter, G. G., Kreider, J. L., & Yeates, B. F. (1983). Relationship between condition score, physical measurements and body fat percentage in mares. Equine Veterinary Journal, 15,371-372. [ Links ]
Hughes, J. P., Stabenfeldt, G. H., & Evans, J. W. (1972). Estrous cycle and ovulation in the mares. Journal of the American Veterinary Medical Association, 161, 1367-1374. [ Links ]
Irvine, C. H. G. (1993). Prostaglandins. In A. O. Mckinnon & J. L. Voss (Eds.), Equine reproduction (Chap. 34, pp. 319-324). Philadelphia: Lea & Febiger. [ Links ]
Kurtz Filho, M., Alda, J. L., Deprá, N. M., Brass, K. E., La Corte, F. D., Silva, J. H. S., Silva, C. A. M., & Emanuelli, I. P. (1998). Fertilidade pós-parto em éguas Puro-Sangue de Corrida. Brazilian Journal of Veterinary Research an Animal Science, 35, 75-79. [ Links ]
Mckinnon, A. O., & Voss, J. L. (Eds.). (1993). Equine reproduction. Philadelphia: Lea & Febiger. [ Links ] Pickerel, T. M., Crowell-Davis, S. L., Caudle, A. B., & Estep, D. Q. (1993). Sexual preference of mares (Equus caballus) for individual stallions. Applied Animal Behaviour Science, 38, 1-13. [ Links ]
Romano, M. A., Mucciolo, R. G., & Feliciano e Silva, A. E. D. (1998). Biologia reprodutiva de éguas: estudo do ciclo estral e momento da ovulação. Brazilian Journal of Veterinary Research an Animal Science, 35, 25-28. [ Links ]
Sampaio, I. B. M. (1998). Estatística aplicada à experimentação animal. Belo Horizonte: Fundação de Ensino e Pesquisa em Medicina Veterinária. [ Links ]
Silva, A. M. D. F., Unanian, M. M., Esteves, S. N. (1998). Criação de eqüinos: manejo reprodutivo e da alimentação. Brasília, DF: EMBRAPA. [ Links ]
Squires, E .L. (1993). Progestin. In A. O. Mckinnon & J. L. Voss (Eds.), Equine reproduction (Chap. 33: pp. 311-318). Philadelphia: Lea & Febiger. [ Links ]
Wilde, O. R., de La Vega, A. C., & Cruz, M. L. (2002). Uso de un dispositivo intravaginal para el control del estro en yeguas. Zootecnia Tropical, 20, 483-492. [ Links ]
Zúccari, C. E. S. N., Nunes, D. B., & Corrêa Filho, R. A. C. (2002). Eficiência reprodutiva de éguas da raça Pantaneira durante as estações de monta 1995/2000.Archivos Zootecnia, 51, 139-148. [ Links ]
 Endereço para correspondência
Endereço para correspondência
Profa. Dra. Carmem Estefânia Serra Neto Zúccari
Departamento de Zootecnia - DZO
Faculdade de Medicina Veterinária e Zootecnia - FAMEZ
Universidade Federal de Mato Grosso do Sul - UFMS
Avenida Senador Filinto Müller, 2443 - Campus Universitário
Campo Grande - MS - Cep: 79070-900
E-mail: zuccari@nin.ufms.br
Received April 10, 2006
Revision received August 28, 2006
Accepted September 11, 2006












 Curriculum ScienTI
Curriculum ScienTI

