Serviços Personalizados
Journal
artigo
Indicadores
Compartilhar
Revista de Etologia
versão impressa ISSN 1517-2805
Rev. etol. vol.9 no.2 São Paulo dez. 2010
ARTIGO
Comportamento reprodutivo de Cacicus cela Linnaeus, 1758 (Passeriformes: Icteridae) na Área de Proteção Ambiental do rio Curiaú, Amapá, Brasil
Breeding behavior of the yellow-rumped cacique Cacicus cela Linnaeus, 1758 (Passeriformes: Icteridae) in the Curiau Protection Area, Amapa, Brazil
Eliane Furtado Silva; Carlos Eduardo Costa Campos
Universidade Federal do Amapá
RESUMO
O japim, Cacicus cela é uma espécie de Passeriformes que se reproduz em colônias e habita floresta úmida, floresta secundária incluindo floresta decídua e mata de galeria. O objetivo deste trabalho foi descrever aspectos da reprodução dessa espécie na Área de Proteção Ambiental do rio Curiaú, Macapá, Brasil. Oito colônias foram monitoradas em áreas antropizadas e em mata de galeria durante a estação reprodutiva. O tempo médio de construção dos ninhos foi de 19,8 ± 8,3 dias. A altura dos ninhos em relação ao solo variou de 4,0 a 8,0 metros em diferentes colônias. Considerando todos os ninhos, inclusive os que foram perdidos ou abandonados antes da fêmea fazer a postura, as colônias variaram de 11 a 115 ninhos, com média de 52,7 ± 38,7 ninhos. A estação reprodutiva teve início no mês de outubro. A razão sexual encontrada nos dados de captura foi de (1 macho: 2,7 fêmeas). Somente fêmeas foram vistas incubando os ovos e alimentando os ninhegos. Os cantos mais imitados pelos indivíduos de C. cela foram de aves das famílias Psittacidae, Falconidae, Ramphastidae e Cuculidae.
Palavras-chave: Cacicus cela. Icterinae. Biologia reprodutiva. Área de Proteção Ambiental do rio Curiaú.
ABSTRACT
The yellow-rumped cacique Cacicus cela is a Passeriformes that breeds in colonies being common in secondary forest and woodland, including deciduous forest and gallery woodland. The purpose of this study was to describe several aspects of the reproduction of this species in the Curiaú Protection Area, Macapá, Brazil. Eight colonies were monitored in altered areas and gallery woodland during the breeding season. The building mean time was 19.8 ± 8.3 days. The height of the nests in relation to the ground varied of 4.0 the 8.0 meters in different colonies. Considering all the nests, also the ones that lost or had been abandoned before the female making the position, the colonies had varied of 11 the 115 nests, with 52.7 ± 38.7 nests. The reproductive station had beginning in the October month. The sex ratio in the capture data was of (1 male: 2.7 females). The incubation and fledgling was females. The song types more imitated by the individuals of C. cela were of birds of the families Psittacidae, Falconidae, Ramphastidae and Cuculidae.
Keywords: Cacicus cela. Icterinae. Reproductive biology. Curiaú Protection Area.
As aves são muito utilizadas como indicadores biológicos e um maior ecossistemas (e.g. espécies típicas de florestas são sensíveis ao desmatamento e apresentam declínios populacionais ou mesmo extinções locais após alterações do hábitat) (cf. Willis & Oniki, 1992; Silva, 1996). O conhecimento taxonômico da avifauna do Brasil é bom, com famílias, gêneros e espécies bem estabelecidos, sendo um dos grupos de vertebrados mais conspícuos e estudados, acreditando-se que, comparativamente, existam menos espécies por serem descritas.
As comunidades de aves podem ser utilizadas como ferramenta para avaliação das mudanças na composição e estrutura do habitat, pois apresentam hábitos diurnos e conspícuos, principalmente pelo fato de serem bastante sensíveis a modificações em seu habitat (Askins, Philbrick & Sugeno, 1987; Wiens, 1989; Toledo, 1993; Stotz et al., 1996). Estas informações são indispensáveis para caracterizar e monitorar os ecossistemas e assim contribuir para a conservação da biodiversidade.
Estudos sobre as comunidades de aves têm sido realizados em diversos biomas brasileiros nas últimas décadas (Novaes, 1970; Negret, 1983; Silva & Constantino, 1988; Bierregaard, 1990; Aleixo & Vielliard, 1995; Santos, 2001). O bioma Mata Atlântica é o melhor amostrado e conhecido e com o maior número de espécies registradas, embora a diversidade de espécies na Amazônia ainda seja subestimada, devido ao número de coletas relativamente pequeno (Whittaker & Oren, 1999). De um total de 930 espécies descritas para a Amazônia, cerca de 44% são endêmicas, envolvendo 60 gêneros endêmicos (Haffer, 1974). Embora a diversidade de aves seja mais bem conhecida, comparativamente às outras classes de vertebrados, a maioria das espécies é pobremente estudada sob os mais diferentes aspectos de sua biologia e ecologia (e.g comportamento reprodutivo).
O comportamento das aves durante o período reprodutivo ainda não é bem conhecido para muitas espécies brasileiras. Desta forma, estudos que visam conhecer os atributos da reprodução das espécies são essenciais para a definição segura de estratégias para a conservação e manejo (Robinson, Brawn & Robinson, 2000). Os fatores proeminentes que condicionam as atividades reprodutivas são a obtenção do material para a confecção do ninho e a fartura de alimento, facilitando a criação dos ninhegos (Sick, 1997).
A atividade reprodutiva das aves segue uma regra geral, que vai desde a corte até que os ninhegos abandonem os ninhos e se tornem independentes dos pais (Welty, 1975). A reprodução começa com os machos emitindo seus cantos característicos em intervalos frequentes. Muitos realizam ritos nupciais na presença da fêmea, os sons e contatos envolvidos no cortejar reforçam a união do par e promovem a prontidão sexual. Em muitas espécies, durante a atividade reprodutiva, o macho apodera-se e defende um território de predadores ou de outros machos da mesma espécie (Sick, 1997).
O cuidado parental com a prole é uma das características mais marcantes da reprodução das aves, sendo a construção do ninho considerada "uma extensão do cuidado parental". Estes podem ser de cavidades (e.g. buracos construídos em árvores, na areia ou em barrancos) ou abertos (e.g. em forma de taça, usado pela maioria das aves que nidificam em árvores). Quase todas as aves constroem seus ninhos, apresentando padrões comportamentais bastante elaborados nessa tarefa, na qual a fêmea participa dessa construção, sozinha ou com a ajuda do macho. Algumas espécies oportunistas depositam seus ovos em ninhos confeccionados por outras aves, comportamento conhecido nidoparasitismo (Duca & Marini, 2005).
Muitas espécies de aves durante a atividade reprodutiva formam bandos, um tipo de associação que se mantém e é causada por respostas comportamentais mútuas entre seus integrantes (Moynihan, 1962). Indivíduos que participam de bandos podem ser beneficiados pela maximização de forrageio (Morse, 1970; Murton, 1971), diminuição dos riscos de predação (Lazarus, 1972; Willis, 1972) ou ambas (Moynihan, 1962; Powell, 1985). A sazonalidade reprodutiva influencia no número de indivíduos e de espécies nos bandos, a frequência de ocorrência dos bandos (Moynihan, 1962; Munn, 1985; Powell, 1985; Morrison et al., 1987; Machado, 1991) e sua composição, através da diminuição da participação de diversas espécies durante seu período reprodutivo e do ingresso de espécies migrantes (Moynihan, 1962; Powell, 1985; Alves, l988; Machado, 1997).
Devido à ausência de dados acerca da atividade reprodutiva da avifauna, este estudo tem como objetivo descrever características da biologia de nidificação de Cacicus cela Linnaeus, 1758 (Passeriformes: Icteridae), incluindo período de nidificação, construção de ninho, incubação e cuidado parental.
Material e Métodos
Área de estudo
A Área de Proteção Ambiental (APA) do rio Curiaú foi criada pelo Decreto n°. 1417, de 28 de setembro de 1992 e, neste mesmo dia, foi assinado o Decreto n°1418/92 tornando o Curiaú como Patrimônio Cultural do Amapá. Localizada no município de Macapá-AP, ocupa uma área de extensão de 23.000 ha, sendo delimitada pelas coordenadas 00°14’58"S, 00°14’17"N, 50° 56’ 54"L e 51°07’46"W. O cenário físico natural predominante é caracterizado pelo domínio da bacia do rio Curiaú e de seus ambientes de entorno, formados de importantes ecossistemas florestais, tais como cerrado, floresta tropical úmida e ecossistemas aquáticos como lagos temporários e permanentes (Sá-Oliveira, 2000) (Figura1).
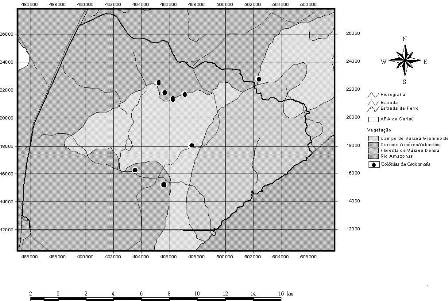
Figura 1. Área de Proteção Ambiental do rio Curiaú e colônias de Cacicus cela monitoradas no período de agosto de 2007 a julho de 2008.
O clima é quente e úmido, típico da região equatorial, com estação chuvosa (janeiro a junho) e estação seca (julho a dezembro com precipitação média anual de 2.500 mm e temperaturas que variam de 27C° a 32C°) (Ab’saber, 1977). Particularmente, a planície de inundação do rio Curiaú é justificada pela natureza de drenagem de toda bacia do rio Curiaú, ocorrendo época da estiagem (seca), que compreende os meses de julho a dezembro, e da inundação, justificada pelo abastecimento de água na estação das chuvas (cheia), a qual compreende os meses de janeiro a junho (Sá-Oliveira, 2000).
Espécie em estudo
O japim, Cacicus cela Linnaeus, 1758 é uma espécie da família Icteridae exclusivamente neotropical que ocorre do Panamá ao Norte do continente, até a Bolívia, Mato Grosso do Sul, Goiás e Sul da Bahia. Habita floresta úmida, floresta secundária incluindo floresta decídua, mata de galeria, mata de várzea, campos abertos do cerrado e caatinga. É comum no dossel, bordas de florestas e beira de rios (Feekes, 1981; Ridgely & Tudor, 1989), apresentando uma amplitude ecológica maior que Cacicus haemorrhous (Feekes, 1981). Apresenta bico cônico e liso, em muitos casos notavelmente pontiagudo, tomando a forma de uma pinça ou de um compasso.
De porte robusto, o macho é bem maior do que a fêmea cerca de um terço; indivíduos imaturos apresentam cor fuligem ao invés de negra. Nidificam em colônias pequenas ou grandes, frequentemente em árvores baixas do cerrado ou na borda da mata galeria, muitas vezes em galhos cobertos com ninhos de formigas ou vespeiros. Os ninhos, feitos de folíolos de palmeiras, são uma bolsa relativamente curta e larga e costumam estar bem juntos (Sick, 1997).

Figura 2. Espécie em estudo, Cacicus cela Linnaeus, 1758.
Metodologia
Os métodos utilizados para o registro e comportamento reprodutivo de Cacicus cela foram feitos através de: (1) levantamento por pontos fixos (através de contatos visuais e auditivos); (2) captura dos indivíduos com redes de neblina e (3) método de espreita (sentar e esperar), anotando todas as atividades realizadas pela espécie em estudo.
As observações foram realizadas a partir de um ponto fixo, no solo, situado em frente ao ninho, a cerca de seis metros da árvore onde o mesmo estava localizado. As observações foram realizadas com o auxílio de binóculos 8X40 e 7x35, luneta com tripé e cronômetro. Para a gravação das vocalizações foi utilizado gravador Sony TCM 5000EV e microfone Sennheiser ME66 e, tentativamente identificadas dentro do seu contexto comportamental (e.g. chamadas de contato e pedinchar dos filhotes). Os trabalhos iniciavam-se por volta das 05h, quando ainda estava escuro, e o observador só deixava o ponto à noite, após às 18h30.
Quando iniciou as atividades reprodutivas (construção dos ninhos), cada colônia passou a ser visitada em intervalos de 3 dias. Nestas visitas os ninhos eram observados e avaliados quanto ao seu conteúdo. Para cada ninho foram registradas as datas de início e conclusão da construção dos ninhos, data de postura e eclosão dos ovos e a data em que o ninho ficou inativo. A cada visita também foi feito um censo dos indivíduos através da contagem de machos e fêmeas presentes na colônia nos primeiros 3 minutos de observação.
Resultados e Discussão
Foram observadas oito colônias de Cacicus cela na APA do rio Curiaú em áreas antropizadas e em mata de galeria. Os primeiros sinais de início de atividades reprodutivas foram registrados em 11 de agosto de 2007, quando foram observados 10 indivíduos (8 machos e 2 fêmeas) visitando uma colônia com 11 ninhos inativos construídos em uma árvore de angelim (Dinizia excelsa, Leg. Mimosoideae). Nesta época foram observadas exibição de display "Bowing display" (cf. Feekes, 1981) pelos machos e verificação dos ninhos inativos pelas fêmeas.
Em 25 de agosto de 2007, cinco das oito colônias observadas estavam ativas e os indivíduos já haviam começado a construção dos novos ninhos. Dessas cinco colônias que vinham sendo observadas, uma foi completamente abandonada antes mesmo que alguma fêmea iniciasse a postura dos ovos. Em outra colônia, apenas sete ninhos foram construídos, porém somente uma fêmea fez a postura de um ovo, abandonando o ninho após dez dias e a colônia ficou inativa. Essas colônias não foram mais observadas, sendo desconsideradas nas análises.
Nos meses de outubro a novembro de 2007, foram capturados 86 fêmeas e 32 machos de C. cela, totalizando 118 indivíduos capturados na área de estudo. Das 86 fêmeas capturadas, 78 foram registradas com placa de incubação. Entre os machos, nenhum apresentou placa de incubação e apenas 17 apresentaram protuberância cloacal. A ausência de placa de incubação nos machos é um indício da não participação dos machos na incubação dos ovos. Em nenhum momento foram observados machos participando das atividades de construção do ninho, da incubação dos ovos ou da alimentação dos filhotes, sendo todo esse trabalho desenvolvido exclusivamente pelas fêmeas, comportamento também descrito para C. haemorrhous (Duca & Marini, 2005). Apesar disso, sempre houve pelo menos um indivíduo macho presente na colônia durante todo o período reprodutivo. Os machos dividiam o território por ninhos, cerca de 7 ninhos por macho, e competiam pela guarda dos ninhos e das fêmeas.
Segundo Sick (1997), nas espécies de icteríneos florestais que se reproduzem em colônias, a fêmea costuma se encarregar sozinha da construção dos ninhos e da alimentação dos ninhegos. Embora os machos não participem destas tarefas, eles são importantes durante todo o período reprodutivo, emitindo chamados de alerta com a aproximação de predadores e atacando intrusos (Feekes, 1981; Robinson, 1986).
A razão sexual encontrada nos dados de captura foi 1 macho: 2,7 fêmeas. Esses dados diferem da razão sexual estabelecida por Feekes (1981) para a subespécie do norte, C. haemorrhous haemorrhous, 1 macho: 1,5 fêmeas. Dados do censo realizado em cada dia de observação demonstraram que o número de machos na colônia tende a aumentar quando muitas fêmeas estão construindo ninho (podendo chegar a 1 macho: 1,3 fêmea). À medida que as fêmeas iniciam a incubação, o número de machos na colônia tende a diminuir, chegando a 1 macho para 8 fêmeas). Feekes (1981) também observou uma diminuição do número de machos nas colônias e arredores assim que as fêmeas começaram a incubação. Porém, a razão sexual (1 macho: 20 fêmeas) encontrada por Feekes (1981) nessa fase chegou a um valor a favor das fêmeas consideravelmente maior do que o encontrado neste estudo (1 macho: 8 fêmeas).
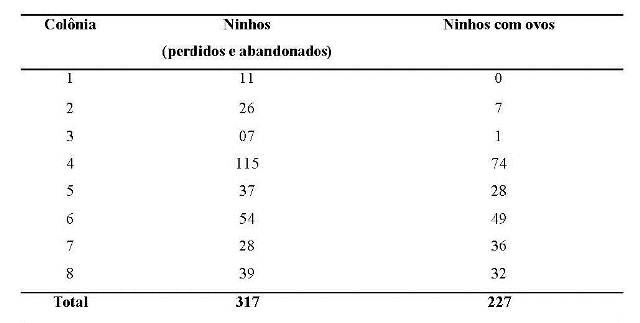
Durante o período reprodutivo três colônias foram observadas. Considerando todos os ninhos, inclusive os que foram perdidos ou abandonados antes da fêmea fazer a postura, as colônias variaram de 11 a 115 ninhos, com média de 52,7 ± 38,7 ninhos. Considerando as três colônias, obtivemos um total de 317 ninhos. De acordo com Robinson (1985) o tamanho das colônias de C. cela varia de 2 a 250 ninhos. Nessas colônias, a variação de ninhos que chegaram a ter ovos foi de 7 a 74 ninhos, com média de 32,6 + 24,6 e um total de 227 ninhos (Tabela 1).
Tabela 1. Número total de ninhos (perdidos e abandonados) e número de ninhos em fase de incubação (com ovos) das colônias de Cacicus cela na APA do rio Curiaú, Amapá.
A altura dos ninhos em relação ao solo variou de 4,0 a 8,0 metros em diferentes colônias. A altura média foi de 3,6 ± 1,8 metros em relação ao solo. A distância entre as colônias variou de 0,5 a 4,0 km, com média de 2,2 ± 1,0 km. Das três colônias observadas, duas estavam em diferentes espécies de árvores, mostrando que C. cela não é seletivo a este respeito. Em uma colônia havia a presença de ninhos de outra espécie de ave na mesma árvore. Esses ninhos foram de duas espécies da Família Tyrannidae, Pitangus sulphuratus e Legatus leucophaius, sendo esta última inquilina de várias colônias de C. cela (cf. Sick, 1997).
No presente estudo não foram observadas evidências de preferência de C. cela por alguma espécie de árvore em particular para estabelecimento das colônias reprodutivas. Essa falta de preferência por uma espécie de árvore também é relatada para a subespécie do norte por Feekes (1981). A presença de ninhos de outras espécies da família Tyrannidae na maioria das colônias de C. cela sugere a existência de algum tipo de associação entre as espécies. Aparentemente, este tipo de associação acontece devido aos benefícios advindos de defesa mais eficaz contra predadores de ninhos e tem sido observada para várias outras espécies (Groom, 1992; Larsen & Grundetjern, 1997; Richardson & Bolen, 1999).
Os primeiros indícios de atividade reprodutiva tiveram início no mês de agosto com o agrupamento de indivíduos em locais de estabelecimento de colônias. Porém, somente no mês de setembro registrou-se o início das atividades de construção dos ninhos, e a estação reprodutiva teve início no mês de outubro, com a postura do primeiro ovo registrada no dia 5 desse mês. Os primeiros ovos que eclodiram foram registrados em 26 de outubro, quando também se observavam fêmeas na fase inicial de confecção dos ninhos. O registro de ninhos ativos ocorreu entre o período de outubro a fevereiro, com o pico de registro no mês de novembro (Figura 3). Entre os meses de março e julho de 2008 não foram registrados ninhos ativos na área de estudo. O tempo de atividade das colônias variou de 7 a 15 semanas, com média de 12,1 ± 3,4 semanas.
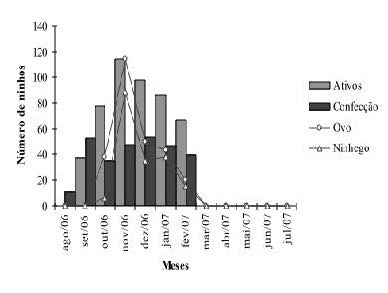
Figura 3. Número de ninhos ativos, em confecção, com ovos e ninhegos de C. cela observados durante o período de agosto de 2007 a julho de 2008 na APA do rio Curiaú, Amapá.
O período de nidificação de C.cela é semelhante ao de várias espécies da região centro sul e sudeste do país, ou seja, nidificam entre os meses de setembro e janeiro (Marini et al., 1997; Aguilar, Leite, & Marini, 1999; Piratelli, Siqueira, & Marcondes-Machado, 2000; Marini & Durães, 2001; Duca & Marini, 2005).
O tempo médio de construção dos ninhos foi de 19,8 ± 8,3 dias, variando consideravelmente de uma fêmea para outra. O menor tempo de construção de ninho registrado foi de 14 dias e o maior de 68 dias (considerando apenas ninhos que chegaram à fase de incubação). A confecção dos ninhos foi observada entre os meses de setembro de 2007 e janeiro de 2008. Algumas fêmeas chegaram a ficar mais de 70 dias confeccionando o ninho para depois abandoná-lo sem fazer a postura de ovo. De acordo com Robinson (1986, 1988) as fêmeas jovens de C. cela que se empenham em reproduzir precocemente geralmente necessitam de mais tempo para construção dos ninhos do que as fêmeas adultas e, quase sempre, não apresentam sucesso reprodutivo, o que possivelmente está relacionado à falta de habilidade para exercer esta tarefa (Morbey & Ydenberg, 2000).
Somente fêmeas foram observadas trabalhando na construção dos ninhos. As fêmeas competem pelo material de construção dos ninhos, chegando a retirar fios já tecidos nos outros ninhos ativos e inativos, muitas vezes danificando seriamente a estrutura dos ninhos ativos. Os fios utilizados para tecer os ninhos são de folhas das palmeiras Arecaceae (e.g. Astrocaryum aculeatum Meyer, Cocus nucifora L.) e Palmae (e.g. Euterpe oleracea Mart.). Após a postura dos ovos não foram observadas fêmeas fazendo reparos na estrutura de seus ninhos. As colônias foram estabelecidas em locais com presença de formigueiros ou vespeiros, fato observado por Sick (1997).
Neste estudo não foram observados machos de C. cela participando da construção do ninho, da incubação dos ovos ou da alimentação dos ninhegos. Todo esse trabalho foi feito exclusivamente pelas fêmeas. A ausência de placa de incubação nos machos capturados durante a estação reprodutiva reforça a conclusão de que machos não participam da incubação dos ovos. Feekes (1981) descreve este mesmo padrão de comportamento de indivíduos machos para a subespécie do norte (C. haemorrhous haemorrhous). Este comportamento também é descrito para C. cela (Robinson,1986).
A maioria das posturas ocorreu no mês de novembro. Neste mês, de um total de 115 ninhos cujo interior foi examinado de perto, 98 continham dois ovos. O único ninho que possuía apenas um ovo foi abandonado uma semana após a postura. Os ovos examinados eram de forma ovóide e apresentavam uma coloração rosada, com pintas marrons de diversos tamanhos e tonalidades. O tempo médio de incubação foi de 20,3 ± 0,9 dias, e o tempo médio de permanência dos ninhegos no ninho foi de 31,4 + 4,8 dias. Somente fêmeas foram vistas incubando os ovos e alimentando os ninhegos. Embora os machos não participem da incubação dos ovos e do cuidado com os filhotes, eles estão sempre presentes nas colônias e, provavelmente, são importantes em todos os estágios do ciclo reprodutivo, emitindo vocalizações de alerta contra a aproximação de predadores e atacando intrusos (Feekes, 1981; Robinson, 1986).
Durante as observações e gravação dos cantos dos indivíduos de C. cela nas colônias, os cantos mais imitados eram de aves das seguintes famílias: Psittacidae, Falconidae, Ramphastidae e Cuculidae. Os machos emitiam display "bowing display" (cf. Feekes, 1981) para outros machos, os quais também eriçavam as penas, sendo registrada agressão entre machos.
Referências
Ab'saber, A.N. (1977). Os domínios morfoclimáticos da América do Sul. Primeira aproximação. Geomorfologia, 52, 121. [ Links ]
Aguilar, T. M., Leite, L. O., & Marini, M. Â. (1999). Biologia de nidificação de Lathrotricus euleri (Cabanis 1968) (Tyrannidae) em fragmento de mata em Minas Gerais. Ararajuba, 7, 125-133. [ Links ]
Aleixo, A., & Vielliard, J.M.E. (1995). Composição e dinâmica da avifauna da mata de Santa Genebra, Campinas, São Paulo, Brasil. Rev. Bras. Zool., 12, 493-511. [ Links ]
Alves, M.A.S. (1988). Organização social e biologia reprodutiva de Neothraupis fasciata (Passeriformes: Thraupidae). Dissertação de mestrado, Instituto de Biologia, Universidade Estadual de Campinas, Campinas, São Paulo. [ Links ]
Askins, R.A., Philbrick, M.J., & Sugeno, D.S. (1987). Relationship between the regional abundance of forest and the composition of forest bird communities. Biological Conservation, 39, 129-152. [ Links ]
Bierregaard, R.O. (1990). Species composition and trophic organization of the understory burd community in a central Amazonian terra firme forest. In A. Gentry (Ed.), Four Neotropical rainforests (pp. 217-234). New Haven: Yale University Press. [ Links ]
Dubs, B. (1992). Birds of Southwestern Brazil. Catalogue and guide to the birds of the Pantanal of Mato Grosso and its border areas. Küsnacht: Betrona-Verlag. [ Links ]
Duca, C., & Marini, M.A. (2005). Temporal variation in the reproductive success of Cacicus haemorrhous (Linnaeus) (Aves, Icterinae) in an Atlantic Forest reserve in Southeast Brazil. Rev. Bras. Zool., 22 (2), 484-489. [ Links ]
Feekes, F. (1981). Biology and organization of two sympatric Caciques, Cacicus cela and Cacicus haemorrhous (Icteridae, Aves) in Suriname. Ardea, 69, 83-107. [ Links ]
Groom, M. (1992) Sand-colored nighthawks parasitize the anti-predator behavior of three nesting bird species. Ecology, 73, 785-793. [ Links ]
Haffer, J. (1974). Avian speciation in tropical South America. Publ. Nuttall Ornithol. Club., 14, 1-390. [ Links ]
Larsen, T., & Grundetjern, S. (1997) Optimal choice of neighbour: predator protection among tundra birds. J. Avian Biol., 28, 303-308. [ Links ]
Lazarus, J. (1972). Natural selection and the functions of flocking in birds: a replay to Murton. Ibis, 114, 556-558. [ Links ]
Machado, C.G. (1991). Estrutura, composição e dinâmica de bandos mistos de aves na Mata Atlântica do alto da Serra de Paranapiacaba, São Paulo. Dissertação de mestrado, Instituto de Biologia, Universidade Estadual de Campinas, Campinas, São Paulo. [ Links ]
Machado, C.G. (1997). Vireo olivaceus (Vireonidae, Aves): uma espécie migratória nos bandos mistos de aves da Mata Atlântica do sudeste brasileiro. Ararajuba, 5 (1), 62-64. [ Links ]
Machado, C.G.A. (1999). Composição dos bandos mistos de aves na Mata Atlântica da Serra de Paranapiacaba, no sudeste brasileiro. Rev. Bras. Biol., 59 (1), 75-85. [ Links ]
Marini, M. Â., & Durães, R. (2001). Annual cycles of molt and reproduction of passerines from central-south Brazil. Condor, 103, 767-775. [ Links ]
Marini, M. Â., Pereira, M. F., Oliveira, G.M., & Melo, C. (1997). Novos registros de ninhos e ovos de três espécies de aves do Brasil Central. Ararajuba, 5, 244-245. [ Links ]
Morbey, Y. E., & Ydenberg, R. C. (2000). Seasonal decline in nestling growth: support for the parental-quality hypothesis in Cassin´s Auklets. Auk., 117, 1065-1068. [ Links ]
Morrinson, L., With, K.A., Timossi, C.I., & Milne, K.A. (1987). Composition and temporal variation of flocks in the Sierra Nevada. Condor, 89, 739-745. [ Links ]
Morse, D.H. (1970). Ecological aspects of some mixed-species foraging flocks of birds. Ecological Monographs, 40, 119-168. [ Links ]
Moynihan, M. (1962). The organization and probable evolution of some mixed-species flocks of neotropical birds. Smthson. Misc. Collect., 143, 1-140. [ Links ]
Munn, C.A. (1985). Permanent canopy and understory flocks in Amazonia: species composition and population density. Ornith. Mononogr., 36, 683-712. [ Links ]
Murton, R. K. (1971). Why do some birds species feed in flocks? Ibis, 113, 534-536. [ Links ]
Negret, A.J. (1983). Diversidade e abundância da avifauna da Reserva Ecológica do IBGE, Brasília-DF. Dissertação de mestrado, Universidade de Brasília, Brasília. [ Links ]
Novaes, F.C. (1970). Distribuição ecológica e abundância das aves em um trecho da mata do baixo Rio Guamá, Pará. Bol. Mus.Paraense E. Goeldi, sér. Zool., 71, 1-54. [ Links ]
Piratelli, A. J., Siqueira, M. A. C., & Marcondes-Machado, L. O. (2000). Reprodução e muda de penas em aves de sub-bosque na região leste de Mato Grosso do Sul. Ararajuba, 8, 99-107. [ Links ]
Powell, G.V.N. (1985). Sociobiology and adaptive significance of heterospecific foraging flocks in the Neotropics. Ornithol. Monogr., 36, 713-732. [ Links ]
Richardson, D. S., & Bolen, G. M. (1999). A nesting association between semi-colonial Bullock’s orioles and Yellow-billed magpies: evidence for the predator protection hypothesis. Behav. Ecol. and Sociobiol., 46, 373-380.
Ridgely, R.S., & Tudor, G. (1989). The birds of South America. The oscine passerines (V.1). Austin: University of Texas Press. [ Links ]
Robinson, S.K. (1985). Coloniality in the Yellow-rumped Cacique as a defense against nest predators. Auk., 102, 506-519. [ Links ]
Robinson, S.K. (1986). Competitive and mutualistic interactions among females in a neotropical oriole. Anim. Behav., 34, 113-122. [ Links ]
Robinson, S. K. (1988) Anti-social and social behaviour of adolescent Yellowrumped Caciques (Icterinae: Cacicus cela). Anim. Behav., 36, 1482-1495. [ Links ]
Robinson, S. K., Robinson, W. D., & Edwards, C. (2000). Breeding ecology and nest-site selection of songs wrens in Central Panama. Auk., 117, 345-354. [ Links ]
Robinson, W.D., Brawn, J.D., & Robinson, S.K. (2000). Forest bird community structure in central Panama: influence of spatial scale and biogeography. Ecological Monographs, 70, 209-235. [ Links ]
Santos, M.P.D. (2001). Composição da avifauna nas áreas de proteção ambiental Serra da Tabatinga e Chapada das Mangabeiras, Brasil. Bol. Mus. Paraense E. Goeldi, sér. Zool., 17, 43-67. [ Links ]
Sá-Oliveira, J.C. (2000). Estrutura populacional de Calicthys calichthys na Área de Proteção Ambiental do rio Curiaú. Dissertação de mestrado, Universidade Federal do Rio Grande do Norte, Rio Grande do Norte. [ Links ]
Sick, H. (1997). Ornitologia Brasileira (3a ed.). Editora Nova Fronteira. [ Links ]
Silva, J.M.C., & Constantino, R. (1988). Aves de um trecho de mata no baixo rio Guamá – uma reanálise: riqueza, raridade, diversidade, similaridade e preferências ecológicas. Bol. Mus.Paraense E. Goeldi, sér. Zool., 4, 201-210.
Silva, J.M.C. (1996). Distribution of amazonian and atlantic birds in gallery forests of the cerrado region, South America. Ornit.Neotrop., 7 (1), 1-19 [ Links ]
Stotz, D.F., Fitzpatrick, J.W., Parker, T.A., & Moskovits, D.K. (1996). Neotropical Birds – ecology and conservation. Chicago: University of Chicago Press.
Toledo, M.C.B. (1993). Avifauna em duas reservas fragmentadas de Mata Atlântica na Serra da Mantiqueira, São Paulo. Dissertação de mestrado em Ciências, Universidade de São Paulo, Piracicaba, São Paulo. [ Links ]
Welty J.C. (1975). The Life of Birds (2a ed.). Philadelphia: W. B. Saunders Company. [ Links ]
Whittaker, A., & Oren, D. C. (1999). Important ornithological records from the Rio Juruá, western Amazonia, including twelve additions to the Brazilian avifauna. Bull. Brit. Orn. Cl., 119 (4), 235-260. [ Links ]
Wiens, J.A. (1989). The ecology of bird communities. Cambridge University Press. [ Links ]
Willis, E.O., & Oniki, Y. (1992). Levantamento preliminar das aves de inverno em dez áreas do sudoeste do Mato Grosso, Brasil. Ararajuba, 1, 19-38. [ Links ]
Willis, E.O. (1972). Do birds flocks in Hawaii, a land without predators? Calif. Birds, 3 (1), 1-8. [ Links ]
Recebido em: 28/05/2009
Aceito em: 18/11/2010
Eliane Furtado Silva
Universidade Federal do Amapá
Laboratório de Zoologia
Departamento de Ciências Biológicas e da Saude
Rodovia Juscelino Kubitschek, KM-02, Jardim Marco Zero
CEP 68.902-280, Macapá – AP.
e-mail: eliornit@gmail.com
Carlos Eduardo Costa Campos
e-mail: ceccampos@unifap.br














