Serviços Personalizados
artigo
Indicadores
Compartilhar
Journal of Human Growth and Development
versão impressa ISSN 0104-1282versão On-line ISSN 2175-3598
Rev. bras. crescimento desenvolv. hum. v.18 n.3 São Paulo dez. 2008
ARTIGO DE REVISÃO REVIEW ARTICLE
A hipotermia como estratégia protetora de encefalopatia hipóxico-isquêmica em recém-nascidos com asfixia perinatal
Hypothermy as a protective strategy in asphyxiated newborns after hypoxic-ischemic encephalopathy
Adriana Silva de AraujoI; Sídia Serotti PachecoI; Adriana Gonçalves de OliveiraII; Caio ImaizumiI; Luiz Carlos de AbreuI
IEspecialização em Fisiologia. Faculdade de Medicina do ABCIIServiço de Neonatologia. Hospital Maternidade Leonor Mendes de Barros
RESUMO
INTRODUÇÃO: a encefalopatia hipóxico isquêmica neonatal é uma doença devastadora para o cérebro do recém-nascido. Nas últimas duas décadas, as pesquisas experimentais trouxeram grande avanço nos conhecimentos fisiopatológicos. Para a integridade neuronal, é necessária energia suficiente para a célula manter o equilíbrio iônico. A hipotermia tem sido estudada como um método com alto grau de neuroproteção na hipóxia-isquemia (HI).
OBJETIVO: verificar a potencialidade terapêutica da hipotermia como tratamento da encefalopatia hipóxico-isquêmica em recém-nascidos.
MÉTODO: foram consultadas as bases de dados do Medline, Lilacs, Scielo e JCR-ISI. As consultas incluíram artigos registrados entre 1993 e 2008 no idioma Português, Inglês e Espanhol.
DISCUSSÃO: encefalopatia hipóxico- isquêmica neonatal é complicação imediata à asfixia grave e pode causar graus variados de dano cerebral. As características do dano hipóxico isquêmico indicam que existe um período intermediário, em que é possível intervir interrompendo a cadeia de eventos que levam a destruição celular definitiva. Com a finalidade de proteger o cérebro dos insultos isquêmicos, utilizam-se drogas e diferentes procedimentos, tais como manitol, removedores de radicais livres, antagonistas de receptores opiáceos, supressores de metabolismo e hipotermia para minimizar as lesões.
CONCLUSÃO: o resfriamento cerebral é a conduta terapêutica promissora em reduzir danos cerebrais em recém-nascidos.
Palavras-chave: Recém-nascido; hipotermia; paralisia cerebral; fisiopatologia e encefalopatia.
ABSTRACT
INTRODUCTION: The nutritional needs and particularly, the energetic metabolism in childhood is a controversy in the literature.
OBJECTIVE: To characterize the energetic spent at rest in children with sepsis.
METHOD: The database of Medline and SciELO was consulted. We used as search strategy the words: newborn and energy spent or sepsis in all fields.
RESULTS: In the case of sepsis , the child presents immaturity of the enzymatic system, which limits the production of some aminoacids, such as cystein (cistationase enzyme deficit in preterm), taurine, gutamine and nucleotides as coline e inositol. This fact turns those nutrients conditionally essential for children.
CONCLUSION: Many concepts for adults are used in childohood, which is not correct and may cause several consequences to the health of children.
Keywords: Sepsis; newborn; metabolism; infection.
INTRODUÇÃO
A Encefalopatia Hipóxico Isquêmica (EHI) neonatal é uma doença devastadora para o cérebro do recém-nascido; ocorre em aproximadamente seis por 1000 nascidos vivos a termo1,2 e surge como problema de saúde pública de difícil solução.3-5 É mais prevalente nos países em desenvolvimento, é decorrente do insulto em si ou se instala na fase de re-oxigenação-reperfusão.6 Contribui significativamente para a mortalidade e morbidade neonatais, inclui sequelas no desenvolvimento neurológico para 25% a 60% dos sobreviventes.7
Nas últimas duas décadas, as pesquisas experimentais trouxeram grande avanço nos conhecimentos fisiopatológicos, como a descoberta da morte neuronal tardia mediada por liberação de substâncias nocivas, radicais livres e agentes inflamatórios, levando à possibilidade de tratamento mais efetivo.1 Para a integridade neuronal, é necessária energia suficiente para a célula manter o equilíbrio iônico. O Ca2+ representa importante papel na excitação da membrana celular do neurônio que é mantida através de transporte ativo primário, das bombas eletrogênicas de Ca2+ dependentes de ATP.8
A hipotermia tem sido estudada como um método com alto grau de neuroproteção na EHI.5,9 Assim, o objetivo é verificar a potencialidade terapêutica da hipotermia como tratamento da EHI em recém-nascidos.
MÉTODO
Trata-se de manuscrito na forma de síntese de dados. Foram consultadas bases de dados do Journal Citation Reports (JCR-ISI), Medical Literature Analysis and Retrieval System Online (Medline), Scientific Eletronic Library Online (Scielo) e Literatura Latino-Americana e do Caribe em Ciências da Saúde (Lilacs).
A pesquisa abrangeu os anos de 1993 a 2008, utilizando-se os descritores: recém-nascido, hipotermia, paralisia cerebral, fisiopatologia e encefalopatia (esses descritores foram utilizados nos idiomas inglês, português e espanhol). Estes descritores (DECs) foram pesquisados na Biblioteca Virtual em Saúde (BVS) da Biblioteca Regional de Medicina (BIREME).
A seguir, os artigos foram classificados quanto ao seu tipo: revisão sistemática, revisão explanatória e artigos originais (experimentais). Quanto ao modelo do estudo, foram divididos em: caso-clínico, caso-controle, experimental, observacional e síntese-interpre-tativa.
RESULTADOS
A distribuição dos manuscritos é descrita na Tabela 1 e a síntese dos resultados na Tabela 2.
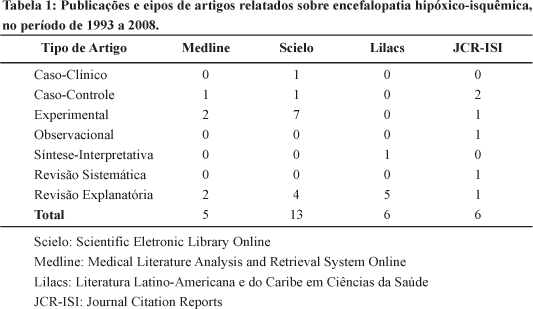

DISCUSSÃO
A Encefalopatia Hipóxico Isquêmica (EHI) neonatal é a complicação imediata à asfixia grave e pode causar graus variados de dano cerebra1, que associados a alterações metabólicas, levam às alterações fisiológicas, que se traduzem por manifestações clínicas secundárias ao comprometimento fisiológico ou estrutural.1,28
Não há mudanças histopatológicas num curto período de isquemia, porém a deterioração no estado energético com mudança metabólica ocorre rapidamente, podendo ser observada nos primeiros cinco minutos pós-isquemia; são mais pronunciadas na zona central do que na zona de penumbra e não progridem nos primeiros 30 minutos.10 O dano cerebral após a isquemia inclui três fases: despolarização, cascata bioquímica e lesão de reperfusão.11
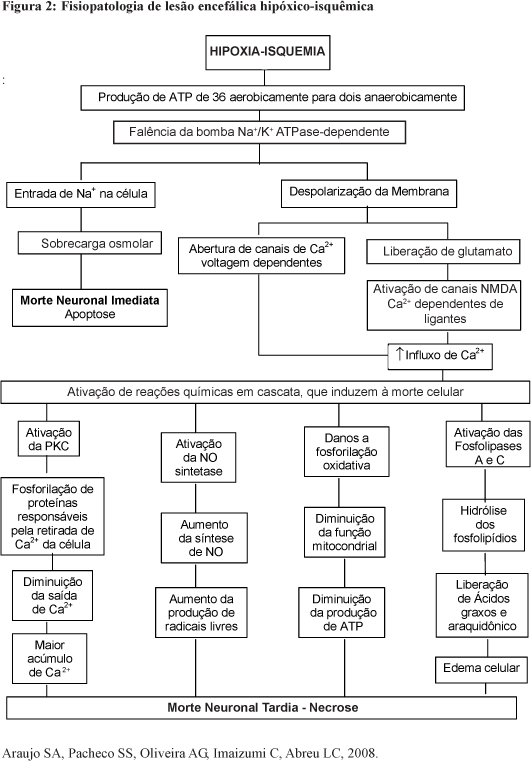
A redução da síntese de ATP prejudica o equilíbrio iônico através da membrana celular, invertendo as concentrações dos íons gerando edema cerebral1,12 e a excitotoxicidade é o processo responsável pelo dano da EHI. John Olney (1970) popularizou este termo, para explicar a fisiopatologia da isquemia cerebral, que se refere à morte celular mediada pelo excesso de estimulação excitatória extracelular nos receptores de aminoácidos.13,14
A cascata de eventos tem início com o neurotransmissor glutamato que atua como aminoácido excitatório no receptor NMDA, relacionado à abertura de canais de Ca2+ que, em altas concentrações, promove alterações indesejáveis como ativação das fosfolipases A e C, que leva a hidrólise dos fosfolipídios e gera agressão celular.14 Os ácidos graxos e o ácido araquidônico são liberados acarretando edema celular1 por influxo de Na+, Cl- e H2O, que resulta em sobrecarga osmolar, ativa mensageiros secundários, fosforilação oxidativa e morte neuronal.1 Neste quadro de excitotoxicidade a produção de radicais livres ultrapassa a defesa antioxidante, gerando lesão na membrana plasmática e no citoplasma neuronal.14
Após esse evento osmótico, ocorrem na mitocôndria liberação do citocromo C que, associado a outros ativadores das caspases, modifica o transporte de elétrons, perda do potencial transmembrana, alteração do ciclo metabólico de óxido-redução, produção de radicais livres pela cadeia transportadora de elétrons e depleção de ATP, fatos estes que corroboram para a morte celular.29,30
Esta condição fisiopatológica gera uma retro-alimentação positiva, ou o chamado Ciclo de Hodkins Positivo, que gera despolarização da membrana, abertura de canais NMDA pelo glutamato e influxo Ca2+. Esse evento é mediado pela membrana plasmática, pelas Ca2+ ATPases do retículo endoplasmático e pelos mecanismos de transporte de Ca2+ ao nível da membrana plasmática, por transporte ativo, resultando em gasto de ATP. Enzimas celulares envolvidas em processos autodigestivos são ativadas pelo excesso de Ca2+ que estimulam uma seqüência de reações enzimáticas tóxicas5,13 que podem ser explicadas como: danos a fosforilação oxidativa, diminuem a função mitocondrial e a produção de energia; Ativação de fosfolipases que agem nos fosfolipídios contribui para a destruição da membrana neuronal; A ativação de proteases pelo Ca2+ com produção de radicais livres que agem na membrana fosfoli-pídica, quebram a membrana e destroem a célula; Ativação da NOsintetase (NOS) aumenta os níveis de NO que produz radicais livres; Ativação da proteína quinase C (PKC), produz fosforilação de proteínas responsáveis pelos mecanismos de saída de Ca2+.14
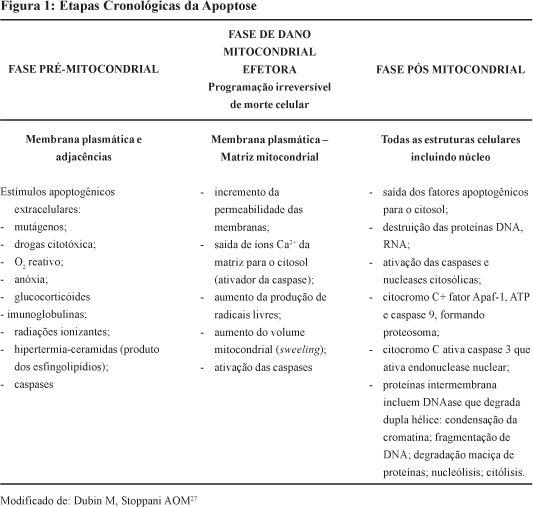
As enzimas caspases, aumentadas pelo NO, ativadas pelo Citocromo C, que é liberado imediatamente após o episódio HI, iniciam e executam a morte celular programada, apoptose.1,15
Simultaneamente, há também a atuação da cascata inflamatória no processo de excitotoxicidade, que é a maior determinante da morte neuronal que segue a isquemia.9 Diversas evidências experimentais indicam seu envolvimento na patogênese da lesão isquêmica cerebral. A isquemia do SNC aciona a reação inflamatória, que se caracteriza pelo influxo de leucócitos e monócitos, sugerindo o envolvimento de diversas citocinas, principalmente interleucina-6 (IL-6), fator de necrose tumoral-α (TNF-α) e IL-1β.2
Os radicais livres, citados acima, agem desordenadamente1,30 e induzem necrose e apoptose29, sobretudo no RN pré-termo que nasce com uma proteção insuficiente contra os radicais livres de O2.12
A necrose é um processo acidental, passivo, onde a morte celular se produz por um dano direto, irreversível, de todas as estruturas celulares, como na isquemia severa.16 O processo pode terminar em uma neoformação tecidual, a cicatrização, com uma deformação da arquitetura do tecido.29
No mecanismo de apoptose a mitocôndria é o ponto principal. No quadro de EHI ela tem sua permeabilidade aumentada através da abertura de poros de transição, liberando múltiplas moléculas pro-apoptóticas, como o Citocromo C e as Caspases 2 e 3.15
Além desses mecanismos de lesão, quando há recuperação do fornecimento de O2 e o restabelecimento da fosforilação oxidativa, ocorrem mais danos. A re-introdução do sangue oxigenado pode desencadear lesões teciduais intensas. Se a cadeia de transporte de elétrons mitocondriais fica comprometida, poderá desencadear alterações eletrolíticas e bioquímicas que aceleram a glicólise, causam produção exagerada de ATP com proporcional aumento da cadeia fosforilativa, fato este que aumenta a acidose lática, desencadeia a produção de radicais livres tóxicos que afetam a recuperação mitocondrial e atuam contra os efeitos benéficos da reperfusão inibindo a respiração mitocondrial o que torna impossível a recuperação ou agrava a lesão inicial. Esta é a situação conhecida como lesão de reperfusão.10,16,17
A manutenção de um fluxo sanguíneo reduzido na área isquêmica permite a ocorrência de disfunção celular sem morte eminente, isto permite uma recuperação celular dependendo do tempo e intensidade da isquemia.10,18 Este território cerebral, conhecido como zona de penumbra, é a meta das tentativas de recuperação nas isquemias definitivas e provavelmente o lugar onde as mudanças metabólicas podem causar a lesão de reperfusão.10
Na fase de reperfusão, os Ácidos Graxos Livres (AGL) acumulados no tecido cerebral, durante a isquemia, sofrem metabolização formando radicais livres que promovem a peroxidação lipídica, que se propaga na forma de uma reação em cadeia autocatalítica.19
A reperfusão parece não interferir com a função mitocondrial em tecidos cerebrais submetidos até 30 minutos de isquemia, porém períodos maiores fazem com que a retomada da função mitocondrial não seja completa e o consumo de O2, mantém-se abaixo do período pré-isquêmico.10,16
Nesta condição clínica o tratamento atual para as crianças com EHI é de suporte, com atendimento para as convulsões e estabilização dos parâmetros fisiológicos.20,21
As características do dano HI indicam que existe um período intermediário, antes do dano secundário, em que é possível intervir interrompendo a cadeia de eventos que levam a destruição celular definitiva. Este período é chamado de janela terapêutica e evidências experimentais sugerem que não dura mais que seis horas.22
Baseando-se nesta janela, estudos focam maneiras de proteger o cérebro dos danos isquêmicos. Muitas drogas e diferentes procedimentos, como hipotermia, uso de manitol, removedores de radicais livres, antagonistas de receptores opiáceos, supressores de metabolismo, entre outros, são testados para minimizar as lesões.21
Outra estratégia protetora utilizada tem sido o resfriamento. Existem comunicações22 que datam de 1964 em estudos controlados que sugeriram uma melhor evolução neurológica em RN resfriados em banhos de água fria por 10 minutos após o nascimento. A hipotermia é um método de tratamento que promove efetividade em seu uso experimental e clínico.15,21
As bases fisiológicas para a neuro-proteção nas lesões isquêmicas encefálicas, através da hipotermia no tratamento da asfixia neonatal, é fato descrito na atualidade.24
Rosommoff, em 1956, foi o primeiro a reportar que a hipotermia profunda (23 °C) reduzia o dano isquêmico após uma oclusão experimental da artéria cerebral média em cães. Igualmente, a hipotermia profunda ficou limitada devido ao grande número de efeitos indesejáveis quando da sua utilização, tais como, acidose, hipercoagulação sanguínea, demora na recuperação da anestesia, comprometimento hemodinâmico, arritmia miocárdica e hipotensão.
Por outro lado, a partir dos anos 90, diversos estudos têm corroborado com a hipótese do uso da hipotermia moderada (31°C - 33°C), aquela mantida durante 80 a 100 minutos, de apresentar as mesmas propriedades protetoras, sem os efeitos deletérios da hipotermia profunda.9,23,24
Os riscos deste procedimento são proporcionais ao grau de resfriamento, quando o mesmo ocorre em temperaturas abaixo de 34ºC.25 Relatos de Blackmon et al.26 descrevem que Miller e Westin demonstraram um aumento na sobrevivência, sem paralisia cerebral ou retardo mental, em recém-nascidos que foram rapidamente resfriados de 23ºC a 32ºC. Outrossim, um alto grau de proteção cerebral foi confirmado pelo abaixamento da temperatura a 32°C até duas horas após o dano isquêmico.9
Estudos experimentais em animais têm demonstrado que a moderada hipotermia, com uma redução de 3 a 4°C da temperatura corporal, imediatamente após a HI, preserva o ATP, reduz o edema citotóxico e melhora a função do tecido encefálico.20,26 Por outro lado, a redução da temperatura após seis horas do evento HI, e com instalação de crises convulsivas, não produz efeito neuroprotetor.18
A base biológica da neuroproteção com a hipotermia baseia-se no decréscimo no metabolismo energético, a diminuição da demanda de O2 pelo encéfalo, redução na densidade de aminoácidos excitatórios, redução da produção de radicais livres de O2 e redução da infiltração leucocitária nas áreas isquêmicas, diminuição da ativação microglial e da despolarização isquêmica.9,11,15,22,23,26
Há diminuição do volume de edema cerebral, a liberação de Citocromo C e a sua ativação são menores após 72 horas de hipotermia, inferindo que a hipotermia pode atuar como inibidor da ativação das caspases no cérebro do RN, prevenindo a morte celular por apoptose.15
A hipotermia com resfriamento do corpo inteiro até 33,5 ºC, realizada nas primeiras seis horas após o nascimento e continuada por 72 horas reduz a morte e as sequelas severas e moderadas em RN de termo com encefalopatia. Em estudos experimentais em animais (ovelhas, ratos e porquinhos da índia), a hipotermia demonstrou ser benéfica quando implementada até cinco horas e 30 minutos após a isquemia cerebral.4,20,21,26
Por outro lado, a hipotermia seletiva da cabeça combinada com uma moderada hipotermia sistêmica de 34,4°C é um estável e bem tolerado método de reduzir a temperatura cerebral.21
A hipotermia de corpo inteiro associada com a hipotermia seletiva da cabeça tem sido utilizada com o intuito de minimizar o risco de efeitos adversos sistêmicos.20 Shankaran et al.7 demonstram, em estudos com animais, que houve benefícios da hipotermia de corpo inteiro em reduzir a morte e as sequelas severas e moderadas no período neonatal.
A hipotermia de RN com EHI pode ser benéfica sobre a morte ou as sequelas em latentes avaliados aos 18 e 22 meses. Os efeitos adversos podem ser considerados pequenos se comparados aos benefícios potenciais7. Além disso, são proporcionais ao grau de resfriamento, com problemas de maior significância clínica ocorrendo em temperaturas bem abaixo de 34°C. No entanto, experimentalmente, a neuroproteção ocorre em temperaturas de 34°C ou maiores.5,21,25
Questões relevantes como temperatura, tempo de resfriamento e reaquecimento, local de resfriamento, ainda precisam ser respondidas20, bem como o uso concomitante de medicamentos removedores de radicais livres e antagonistas de glutamato.18
O sistema nervoso central (SNC) apresenta grande vulnerabilidade aos danos HI. Nestas condições, diversos mecanismos de lesão são ativados e se comportam como uma cascata bioquímica num processo de excitotoxicidade, causando a morte de diversos neurônios.
Além disso, há lesão de reperfusão, causada por reações químicas que ocorrem em alguns neurônios no momento em que a circulação sanguínea e o fornecimento de O2 são regularizados, aumentando a lesão causada pelo dano inicial.
Por haver tantos mecanismos de lesão para o insulto HI, até a atualidade não existe um tratamento eficaz para impedir a instalação da EHI. Portanto, diversos estudos têm sido desenvolvidos com a finalidade de buscar este tratamento. Evidências indicam que a hipotermia em RN com EHI moderada ou severa, vem demonstrando eficácia neuroprotetora, pois reduz os riscos de morte e sequelas neurológicas sem efeitos adversos significativas.
A consistência dos benefícios e suas bases científicas indicam que a hipotermia pode ser uma opção atrativa para a neuroproteção na EHI, porém para efetivá-la ainda são necessários mais estudos randomizados que comprovam este efeito benéfico.
Assim, a hipotermia é uma terapia promissora que precisa ser considerada e investigada o mais breve possível. Para confirmar a segurança e eficácia em testes com humanos, é necessária a realização de estudos randomizados e controlados.20 Os recém-nascidos com encéfalopatia hipóxico-isquêmica desenvolvem quadros clínicos que os limitam nas atividades diárias, quer com lesões pontuais ou extensas do sistema nervoso.
A hipotermia é um recurso terapêutico a ser considerado na estratégia dea tratamento dos recém-nascidos acometidos com encefalopatia hipóxico-isquêmica.
REFERÊNCIAS
1. Neves LAT. Encefalopatia hipóxico-isquêmica neonatal aspectos fisiopatológicos. Rev Med Minas Gerais 2005; 15: S43-S47. [ Links ]
2. Silveira RC, Procianoy RS. Níveis de interleucina-6 e fator de necrose tumoral-alfa no líquor de recém-nascidos a termo com encefalopatia hipóxico-isquêmica. Jornal de Pediatria 2003; 79: 297-302. [ Links ]
3. Cerqueira NF, Yoshida WB. Óxido nítrico. Revisão. Acta Cirúrgica Brasileira 2002; 17: 417-423. [ Links ]
4. Carlotti CG, Colli BO, Kazuo JY. Avaliação da isquemia cerebral pela respiração mitocondrial. Arq Neuropsiquiatr 2001; 59: 365-371. [ Links ]
5. Shankaran, S. et al. Whole-Body hypothermia for Neonatal Encephalopathy: Animal observations as a Basis for a Randomizer, Controled Pilot Study in Term Infants. Pediatrics 2002; 110: 377-385. [ Links ]
6. Martinelli, S. et al. Sofrimento Fetal: Fisiopatologia da Lesão Cerebral e Prevenção por Medicamentos. Rev. Ginec. & Obstet 1998; 239-245. [ Links ]
7. Schulzke, S. M. et al. A systematic review of cooling for neuroprotection in neonates with hypoxic ischemic encephalopathy - are we there yet?. BMC Pediatrics 2007; 7:30-38. [ Links ]
8. Hilbig A, Coutinho AMB. Fisiopatologia da isquemia cerebral. Revista Pesquisa Médica 1993; 27: 45-48. [ Links ]
9. Prandini MN, Neves A, Lapa AJ, Stavale JN. Mild hypothermia reduces polymorphonuclear leukocytes infiltration in inducer brain inflamation. Arq Neuropsiuiatr 2005; 63: 779-784. [ Links ]
10. Duarte SG, Campos AD, Colli BO. Functional evaluation of temporary focal cerebral ischemia. Arq Neuropsiquiatr 2003; 61: 751-756. [ Links ]
11. Rimpilainen J et al. Leukocyte filtration improves brain protection after a prolonged period of hypothermic circulatory arrest: a study in a chronic porcine model. The J Thoracic and Cardiovascular Surgery 2000; 120: 1131-1141. [ Links ]
12. Korc I, Bidegain M, Martell M. Radicales libres. Bioquímica y sistemas antioxidantes. Implicancia en la patologia neonatal. Rev. Méd Uruguay 1995; 11: 121-135. [ Links ]
13. Johnston MV, Trescher WH, Ishida A, Nakajima W. Neurobiology of hypoxic-isquemic injury in the developing brain. Pediatric Research 2001; 49:735-741. [ Links ]
14. Gagliardi RJ. Neuroprotection, excitotoxicicity and NMDA antagonists. Arq Neuropsiquiatr 2000; 58: 583-588.. [ Links ]
15. Zhu C, Wang X, Cheng X, Qiu L, Xu F, Simbruner G, Blomgren K. Post-ischemic hypotermia-induced tissue protection and diminished apoptosis after neonatal cerebral hypoxia-ischemia. Brain Research 2004; 996: 67-75. [ Links ]
16. Nakano H, Colli BO, Roselino JES. Análise da respiração mitocondrial em tecido cerebral de gato após isquemia e reperfusão. Acta Cirúrgica Brasileira 2002; 17: 34-40. [ Links ]
17. Muniz LRF, Faria MHG, Vasconcelos PRL. Avaliação metabólica das lesões de isquemia e reperfusão cerebrais após oclusão bilateral das artérias carótidas comuns: estudo experimental em ratos. Acta Cirúrgica Brasileira 2004; 19: 529-534. [ Links ]
18. Silva OC, Centurion S, Pacheco EG, Brisotti JL, Oliveira AF, Sasso K. Aspectos básicos da lesão de isquemia e reperfusão e do pré-condicionamento isquêmico. Acta Cirúrgica Brasileira 2002; 17: 96-100. [ Links ]
19. Tardini DMS, Yoshida WB, Novelli ELB, Sequeira JL. Avaliação de dois modelos experimentais de isquemia e reperfusão cerebral em ratos com oclusão temporária carotídea associada ou não à oclusão vertebral. Acta Cirúrgica Brasileira 2003; 18: 502-508. [ Links ]
20. Rutherford, M. A. et al. Mild Hypotermia and the Distribution of Cerebral Lesions in Neonates With Hypoxic-Ischemic Encephalopathy. Pediatrics 2005; 116:1001-1006. [ Links ]
21. Battin, M. R. et al. Treatment of Therm Infants With Head Cooling and Mild Systemic Hypotermia (35.0° C and 34.5° C) After Perinatal Asphyxia. Pediatrics 2003; 111: 244-251. [ Links ]
22. Gonzáles LH, Toso MP, Kattan JS, Mesa TL, Pérez E. Tratamiente de la asfixia perinatal con hipotermia corporal total (Caso Clínico). Rev. Chil Pediatr 2005; 76: 275-280. [ Links ]
23. Prandini MS, Lacann SN, Valente PR, Stavale JN. Regional mild hipotermia in the protection of the ischemic brain. Acta Cirúrgica Brasileira 2002; 17: 232-235. [ Links ]
24. Blackmon LR, Stark AR. Hypothermia: A neuroprotective therapy for neonatal hipoxic-ischemic encephalopathy. Pediatrics 2006; 117: 942-948. [ Links ]
25. Hickey, R. W. et al. Hypothermia and Hyperthermia in children After Resuscitation From Cardiac Arrest. Pediatrics 2000; 106: 118-122. [ Links ]
26. Shankaran S et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med 2005; 353: 1574-1584. [ Links ]
27. Dubin M, Stoppani AOM. Muerte celular programada y apoptosis. Funcion de las mitocôndrias. Medicina (Buenos Aires) 2000; 60: 375-386. [ Links ]
28. Rotta NT. Paralisia Cerebral: novas perspectivas terapêuticas. Jornal de Pediatria 2002; 78: S48-S54. [ Links ]
29. Roseto A, Brenner C. Apoptosis o la muerte cellular programada. Arch Argent Pediatr 1999; 97: 253-275. [ Links ]
30. Kowaltowski AJ. Alternative mitochondrial functions in cell physiopathology: beyond ATP production. Braz J Med Biol Res 2000; 33: 241-250. [ Links ]
 Endereço para correspondência
Endereço para correspondência
Luiz Carlos de Abreu
Faculdade de Medicina do ABC
Avenida Príncipe de Gales, 821. Santo André, SP
E-mail: abreu.luizcarlos@gmail.com
Recebido em: 16/08/2008
Modificado em: 28/09/2008
Aceito em: 05/11/2008














