Serviços Personalizados
artigo
Indicadores
Compartilhar
Revista Latinoamericana de Psicología
versão impressa ISSN 0120-0534
Rev. Latinoam. Psicol. v.39 n.1 Bogotá abr. 2007
ARTÍCULOS
Comunicación eléctrica en peces sudamericanos del orden gymnotiformes
Electric communication in South American gymnotiform fishes
Omar MacadarI, 1; Ana SilvaII
I Instituto de Investigaciones Biológicas Clemente Estable, Montevideo, Uruguay
II Instituto de Investigaciones Biológicas Clemente Estable; Universidad de la República, Montevideo, Uruguay
ABSTRACT
We present a description of the electrogenic system and the reproductive behavior of Gymnotiform electrical fishes focusing on sexual and seasonal variations of their electric displays, and the communicative value of their social electric signals produced during courtship, using histological techniques and electrophysiological recordings. The pacemaker nucleus organizes the discharge sequence whereas the rest of the system determines the electric organ discharge waveform, which is species specific. During mating, Gymnotiform fishes show electric discharge sexual dimorphism, and generate transient social signals during courtship and gametoposition. Males of Brachyhypopomus pinnicaudatus prolong duration of the late phase of the discharge and generate brief signals characterized by rate increase and amplitude decrease called "Chirps". Females transiently stop their discharge. These courtship transient signals are always produced over a specially large nocturnal rate increase. Chirps and interruptions are repeated in bursts with a temporal association that suggests communication.
Keywords: Electric organ, Gymnotiformes, Brachyhypopomus pinnicaudatus, Courship, Sexual dimorphism.
RESUMEN
Se presenta la organización del sistema electrogénico y de la conducta reproductiva de los peces eléctricos Gymnnotiformes enfatizando las variaciones sexuales y estacionales de sus despliegues eléctricos mediante histología y registros electrofisiológicos de la forma de onda de la descarga y de la actividad de las células componentes. Identificamos un núcleo electromotor bulbar que activa la descarga eléctrica del pez. En la reproducción, los Gymnotiformes exhiben dimorfismo sexual de la frecuencia de descarga y producen señales para el cortejo y la gametoposición. Los machos de Brachyhypopomus pinnicaudatus exhiben prolongación de la segunda fase de la Descarga del Órgano Eléctrico (DOE) y emiten señales breves con aumento brusco de la frecuencia y disminución de la amplitud (Chirps). Las hembras interrumpen su descarga de forma transitoria. Estas señales se sobreimponen a un aumento nocturno de la frecuencia basal. Chirps e interrupciones se producen en ráfagas con asociación temporal precisa que sugiere comunicación.
Palabras clave: Órgano eléctrico, Gymnotiformes, Brachyhypopomus pinnicaudatus, Cortejo, Dimorfismo sexual.
INTRODUCCIÓN
La comunicación intra-específica es una actividad social a través de la cual los individuos se benefician compartiendo información. La adquisición y uso de la información reduce incertidumbre y ayuda a los animales a tomar decisiones cuando deben seleccionar entre alternativas. La comunicación también conlleva costos; por ejemplo, un animal que se exhibe para ser percibido por su pareja, corre el riesgo de ser percibido al mismo tiempo por un predador.
Entendemos cortejo como todo despliegue conductual especializado que se produce previamente a la unión de los gametos. Una de las funciones del cortejo es sincronizar las reacciones de machos y hembras para lograr un apareamiento exitoso. La información temporal sincronizadora proviene inicialmente de factores ambientales (fotoperíodo, temperatura, etc.) que señalan el momento del año adecuado para la reproducción. Pero, aun cuando estén dadas las condiciones ambientales para la reproducción, es necesario que la pareja pacte en forma temporalmente más precisa la gametoposición. Este pacto se establece por el intercambio de despliegues conductuales y es especialmente relevante para el éxito reproductivo de especies con fecundación externa.
Otro aspecto importante del cortejo es el manejo de la agresividad (Bateson y Klopfer, 1975). La presencia cercana de un co-espécimen, indispensable para el apareamiento, no despierta sólo despliegues sexuales sino también agresivos y de escape. El cortejo sirve también para convencer a la pareja de las intenciones reproductivas del cortejante. Aunque es frecuente que durante el cortejo se asocien despliegues agresivos, éstos son mayormente redirigidos hacia posibles competidores extra-pareja. Asimismo, los despliegues de cortejo especie-específicos también favorecen el aislamiento reproductivo; constituyen barreras conductuales para prevenir la hibridización inter-específica (Manning, 1979).
La principal función comunicativa durante la reproducción es la emisión de señales que promueve la atracción de posibles parejas y, a la vez, repele a posibles rivales. En general, las hembras son muy selectivas mientras que los machos tratan de aparearse con la mayor cantidad posible de hembras. La interacción entre estos arriesgados machos y estas hembras especuladoras ha dado lugar a elaboradas y extravagantes exhibiciones de cortejo a lo largo de la evolución.
En el contexto de la reproducción, se emiten diversos tipos de señales. Algunas son bastante simples y estereotipadas como el desarrollo de ornamentos, mientras que otras son construcciones voluntarias y elaboradas que demuestran las habilidades del animal (por ejemplo, el canto de las aves). Los tipos de señales emitidas por cada especie dependen de la modalidad sensorial en que cada una de ellas se especializa. En este sentido, la comunicación eléctrica ha evolucionado en un grupo bastante restringido de peces, en los que el sistema de electro-recepción activa constituye su principal modalidad sensorial. Estos peces intercambian señales eléctricas estableciendo una forma de comunicación inusual, exótica para los humanos, pero perfectamente adaptada a sus condiciones de vida.
El Orden Gymnotiformes está formado por aproximadamente 100 especies de peces eléctricos americanos de agua dulce ampliamente distribuidos en América (desde la Provincia de Chiapas en México hasta la cuenca del Río de la Plata en el sur) (Kirschbaum, 1995). El número de especies y su abundancia son máximas en la cuenca del Amazonas y declina hacia el norte y sur (Silva y cols., 2003). Los Gymnotiformes exhiben reproducción cíclica, y en la región tropical la mayoría de ellos se reproducen durante la estación lluviosa. El importante incremento de precipitaciones determina el aumento de los niveles de los cursos agua y la disminución de la conductividad eléctrica del medio acuático (revisado en Silva, y cols., 2002).
Este capítulo presenta ejemplos de comunicación eléctrica durante el comportamiento reproductivo. Este intercambio de información es de fundamental importancia para el reconocimiento y selección de pareja. Los datos presentados fueron principalmente obtenidos de Brachyhypopomus pinnicaudatus, pez eléctrico de descarga débil ampliamente distribuido en América. Aunque los Gymnotiformes predominan en la zona tropical, también se han adaptado a la zona templada, y por lo tanto a escenarios ambientales muy diferentes.
En el límite sur de la distribución continental del Orden Gymnotiformes (cuenca del Río de La Plata), Brachyhypopomus pinnicaudatus se reproduce en primavera tardía y verano (noviembreenero) en respuesta a las variaciones estacionales de temperatura y fotoperíodo (Silva y cols, 2003). La temperatura ambiente, además de su rol como temporizador del período reproductivo, también modula el ritmo y forma de la descarga del órgano eléctrico (Silva y cols., 2002).
El sistema de electro-recepción activa consta de dos partes fundamentales: un sistema electrogénico que genera las señales eléctricas que se emiten al agua que rodea al animal y un sistema electrosensorial que va desde los electro-receptores cutáneos y nervios aferentes que transcurren por la línea lateral hasta un conjunto ordenado jerárquicamente de centros electrosensoriales centrales.
SISTEMA ELECTROGÉNICO
Los peces eléctricos de descarga débil utilizan un sistema motor modificado que genera señales eléctricas en vez de movimientos. Este sistema electrogénico crea un campo eléctrico alrededor del cuerpo del pez que cumple dos funciones principales: a) electro-localización, detectando objetos con diferente impedancia que el agua en el entorno cercano; y b) electro-comunicación entre coespecímenes, desplegando diferentes señales eléctricas en contextos reproductivos y agonistas (Lissmann y Machin, 1958).
Una de las funciones del sistema electrogénico es su salida electromotora o DOE, señal estereotipada y con propiedades especie-específicas de amplitud y forma de onda, que se emite con las mismas características durante toda la vida de cada individuo. El segundo objetivo de este sistema es controlar el patrón temporal de ocurrencia de estas descargas. El estudio comparado de la organización neural de ambas funciones ha aportado importantes evidencias de las estrategias de organización de los sistemas motores aprovechando la ventaja de una señal estereotipada y fácil de medir con precisión.
La emisión del patrón de descarga resulta del efecto de un pequeño número de neuronas de núcleos ubicados en el diencéfalo (tálamo, CP/PPn) y en el tronco encefálico (SPPn) que actúan sobre un único núcleo bulbar (PMn, Rn) donde se define el ritmo de la DOE. Este comando único activa un sistema espinal y periférico donde se construye y asegura la constancia de la forma de onda de la DOE (véase la Figura 1).
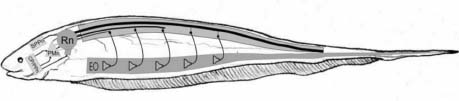
Figura 1. Sistema electro-generador de Brachyhypopomus pinnicaudatus. La porción superior del sistema consta de un marcapaso (PMn) que recibe influencias de dos regiones Pre-marcapaso (PPn). El comando marcapaso excita al Núcleo de relevo (Rn) que envía axones descendentes a la médula espinal donde excita electro-motoneuronas espinales cuyos axones contactan los electrocitos que componen el Órgano Eléctrico (EO) y que se distribuyen todo a lo largo de la zona más ventral del cuerpo del pez.
En Gymnotiformes, con la única excepción de la familia Apteronotidae, el órgano eléctrico está compuesto por varios cientos de electrocitos, células especializadas de origen miogénico inervados por electro-motoneuronas espinales de una forma similar a la usada por las motoneuronas que activan a las fibras musculares esqueléticas (Figura 1). Las propiedades de membrana y el patrón de inervación de los electrocitos determinan la forma de onda de la DOE mientras que el tamaño de los electrocitos determina la potencia eléctrica de la DOE.
El ritmo de descarga se modula finamente en cada instante y despliega un repertorio variado de modulaciones desde cambios graduales de la frecuencia hasta la emisión de complejas señales transitorias. En tanto, la forma de onda de la DOE se modula por cambios lentos que dependen de efectos ambientales y hormonales.
Presentaremos una descripción más detallada del sistema electrogénico de Brachyhypopomus pinnicaudatus ya que su organización es la más sencilla entre los Gymnotiformes y porque las observaciones conductuales que se describirán más abajo se centran en esta especie. El órgano eléctrico de Brachyhypopomus pinnicaudatus está compuesto por electrocitos inervados en su cara caudal que se diferencian en tamaño, densidad y propiedades de membrana a lo largo del órgano eléctrico. Este órgano se extiende desde el borde rostral de la aleta anal hasta la punta de la cola y está formado por cuatro pares de tubos dorso-ventrales de electrocitos alineados (Trujillo-Cenoz, Echagüe y Macadar, 1984). Esta estrategia simple de inervación se refleja en la forma de onda también simple (bifásica) propia de la especie cuando se la registra con un electrodo próximo a la cabeza y otro próximo a la cola (Figura 2).

Figura 2. Dimorfismo sexual en Brachyhypopomus pinnicaudatus. Durante la estación reproductiva, el macho es de mayor tamaño que la hembra y presenta un filamento caudal ensanchado en forma de pluma mientras que la hembra exhibe un filamento caudal delgado. Registros promediados de la DOE muestran que el pulso bifásico especie-específico presenta mayor duración en el macho (principalmente de la segunda fase cabeza-negativa). (Modificado de Hopkins y cols., 1990; Silva y cols., 1999).
La señal de comando para la generación de la DOE es iniciada en un núcleo único bulbar (núcleo marcapaso, núcleo electromotor bulbar), cuyas células poseen las propiedades funcionales de marcapasos celulares (Bennet y cols., 1967; Dye y Meyer, 1986). Este núcleo está compuesto por dos tipos celulares: las células marcapaso y las relé (PMn, Rn en Figura 1). Las neuronas marcapaso son pequeñas células que presentan un potencial de membrana depolarizante lento iniciado después de cada potencial de acción y que alcanza espontáneamente el nivel de disparo para generar la siguiente espiga. Las neuronas relé son neuronas grandes, cuyos axones descienden por la médula espinal y terminan contactando sobre las electro-motoneuronas espinales. El potencial de membrana de las células relé es plano entre espigas y estas neuronas sólo generan un potencial de acción cuando las células marcapaso las excitan. Las neuronas marcapaso exhiben un elevado acople eléctrico entre sí, mayor al observado entre las neuronas relé (Dye y Meyer, 1986).
Las modulaciones del ritmo de la DOE dependen de influencias descendentes excitatorias e inhibitorias sobre el núcleo marcapaso (Figura 1). Diferentes trazadores han demostrado la existencia de núcleos Pre-marcapaso bilaterales en el diencéfalo, que se extienden ventrolateralmente desde el núcleo centroposterior del tálamo. Estos núcleos Pre-marcapaso diencefálicos pueden dividirse en un subnúcleo dorsomedial compuesto por células ovoidales pequeñas y otro subnúcleo ventrolateral compuesto por grandes neuronas multipolares (CP/PPn en Figura 1). Otra influencia sobre el núcleo marcapaso proviene del núcleo Pre-marcapaso sublemniscal, que consiste en un grupo de células ubicadas centralmente con respecto al lemnisco lateral a cada lado de la línea media (SPPn en Figura 1). La mayoría de las proyecciones de este núcleo Pre-marcapaso sublemniscal son glutamatérgicas y terminan sobre las neuronas relé del núcleo electromotor bulbar (Caputti, Carlson y Macadar, 2005; Lorenzo y cols., 2001).
La estimulación del subnúcleo ventrolateral del Pre-marcapaso diencefálico induce la generación de aumentos breves y bruscos de la frecuencia de descarga (Chirps) actuando directamente sobre las células relé sin alterar el ritmo de descarga de las neuronas marcapaso. En forma análoga, la estimulación del núcleo sublemniscal produce una poderosa despolarización de las neuronas relé que se traducen en interrupciones bruscas de la DOE, mientras que las neuronas marcapaso mantienen su descarga normal (Kawasaki y Heilegenberg, 1989; Kawasaki y Heilegenberg, 1990; Spiro, 1997).
COMUNICACIÓN ELÉTRICA DURANTE EL CRTEJO
Los peces eléctricos son modelos experimentales paradigmáticos en neuroetología. Sin embargo, el estudio de la comunicación eléctrica ha tenido un desarrollo paradójico. En la mayoría de los sistemas de comunicación de vertebrados (por ejemplo: el canto de las ranas o de las aves), el significado conductual de las señales comunicativas ha sido develado en detalle aunque no se conocen completamente los circuitos neurales subyacentes. Por el contrario, en peces eléctricos se conocen pormenorizadamente las bases neurales del control de la DOE pero se ha avanzado relativamente menos en la comprensión del rol de las señales eléctricas en el marco de interacciones conductuales particulares.
En esta sección nos centraremos en la comunicación eléctrica durante el comportamiento de cortejo de una población de Brachyhypopomus pinnicaudatus que habita en la región templada. Hablamos de comunicación eléctrica cuando podemos demostrar que la emisión de una señal eléctrica social por parte de un individuo provoca repuestas mensurables de los despliegues eléctricos y/o locomotores en un co-espécimen receptor. También revisaremos los estudios pioneros que demostraron comunicación eléctrica durante el comportamiento reproductivo en otras especies relacionadas de Gymnotiformes.
Señales sociales
Todos los comportamientos en peces eléctricos (cortejo, cuidado parental, agonista) incluyen despliegues eléctricos además de locomotores. La forma de onda de la DOE transporta información de alto valor comunicativo, por ejemplo informa a qué especie pertenece el pez y su estado fisiológico. Durante el período reproductivo, la DOE brinda información más compleja y precisa. Varias especies de Gymnotiformes muestran señales eléctricas dimórficas usadas para el reconocimiento y selección de pareja. Por otra parte, tanto machos como hembras pueden modular la frecuencia de descarga para producir señales sociales transitorias utilizadas en el cortejo y gametoposición.
Dimorfismo sexual
Se ha reportado la existencia de dimorfismo sexual en varias especies de los géneros Brachyhypopomus, Eigenmannia, Apteronotus y Sternopygus y este dimorfismo siempre incluye caracteres morfológicos y eléctricos (Hagedorn y Carr, 1985; Hagedorn y Heilengenberg, 1985; Hopkins, 1991; Hopkins y cols., 1990; Zakon, Thomas y Yan, 1991). En el género Brachyhypopomus, que exhibe una DOE bifásica en pulsos, los machos son más grandes que las hembras y presentan un filamento caudal más ancho y largo. En la Figura 2, se presenta el dimorfismo sexual en una pareja sexualmente madura de Brachyhypopomus pinnicaudatus; se observa en el macho el filamento caudal en forma pluma que le da el nombre a la especie y que la duración de la DOE es mayor en el macho que en la hembra a expensas de un aumento de la segunda fase cabeza-negativa. Estas diferencias morfológicas y electrofisiológicas son sólo observables durante el período reproductivo y ambas revierten fuera de la estación reproductiva.
El dimorfismo sexual en Gymnotiformes, tal como ocurre habitualmente en el resto del Reino Animal, depende de los niveles de hormonas esteroides (Hagedorn y Carr, 1985; Meyer, 1983; Silva y cols., 1999; Zakon, Thomas y Yan, 1991). La manipulación gonadal y la administración de hormonas esteroides puede inducir diferenciación sexual morfológico y eléctrico, o por el contrario revertir el dimorfismo natural existente para que el pez se asemeje al del sexo opuesto. Dado que las diferencias sexuales de la DOE incluyen cambios de forma de onda y variaciones de frecuencia, debemos concluir que hay al menos dos posibles órganos blanco para la acción de las hormonas esteroides gonadales: el órgano eléctrico y el núcleo electromotor bulbar. En Brachyhypopomus occidentales, se ha demostrado que la administración de andrógenos induce una DOE tipomacho que se asocia a un aumento del tamaño de los electrocitos que modifica sus propiedades pasivas de membrana (Hagedorn y Carr, 1985). En cambio, en especies de descarga en onda (Eigenmannia virescens, Apteronotus leptorhynchus y albifrons) los andrógenos actúan directamente sobre el núcleo marcapaso (Dunlap y Zakon, 1998).
Modulaciones de frecuencia
En el marco de la conducta de cortejo en peces eléctricos, se observan cambios transitorios en el ritmo de la descarga (asociados ocasionalmente a cambios de la forma de onda) que se intercalan con períodos de descarga (Bastian, Schnierderjan, Nguyenkim, 2001; Hagedorn, 1988; Hagedorn y Carr, 1985; Hopkins, 1974a y b; Kawasaki y Heilegenberg, 1989; Perrone, 2003; Silva, 2002; Zupanc, 2002). Un pez puede silenciar abruptamente su descarga o hacerlo luego de un decaimiento de la frecuencia, o disparar breves Chirps de alta frecuencia, o producir aceleraciones y desaceleraciones graduales (Figura 3). Estos cambios transitorios son altamente estereotipados y especie-específicos, y se han observado tanto en el hábitat en animales de poblaciones naturales como en el laboratorio a partir de animales criados en cautiverio.

Figura 3. Modulaciones de frecuencia durante el comportamiento de cortejo en Brachyhypopomus pinnicaudatus. Se han identificado tres tipos de Chirps emitidos por machos (A-C) e interrupciones de la DOE producidas por las hembras (gráficas inferiores). En los cuadros de la izquierda se presentan los registros de la DOE de parejas macho-hembra (la DOE del macho y de la hembra son la de mayor y menor amplitud, respectivamente en cada uno de los registros). En los cuadros de la derecha, se presentan las gráficas intervalo-tiempo para el macho (triángulos negros) y la hembra (cuadrados vacíos). (Modificado de Silva; 2002; Perrone, 2003).
En la mayoría de las especies en las que ha sido estudiado, se observan Chirps emitidos durante interacciones sexuales y agonistas. Fueron inicialmente descritos en Apteronotus como "pings" por Larimer and MacDonald (1968) y fue Bullock (1969) quien los denominó "Chirps" debido al sonido que los caracteriza cuando el registro eléctrico se conecta a un parlante. El Chirp se define como un aumento brusco y breve de frecuencia de la DOE generalmente asociado a disminución de la amplitud y desorganización de su forma de onda. En Apteronotus leptorynchus, los Chirps duran típicamente entre 10 y 30 ms, pero durante el cortejo pueden durar más de 100 ms (Bastian, Schnierderjan, Nguyenkim, 2001; Zupanc, 2002). Los Chirps de máxima frecuencia y larga duración pueden implicar un decaimiento de la amplitud de la DOE, que en el caso de Eigenmannia virescens, puede llegar al cese de la descarga (Hopkins, 1974).
Dentro de una misma especie, se observan diferentes tipos de Chirps, y se especula sobre el significado comunicativo particular de cada uno de ellos. En Apteronotus leptorynchus, se han identificado cuatro tipos de Chirps emitidos diferencialmente por machos y hembras (Bastian, Schnierderjan, Nguyenkim, 2001; Zupanc, 2002). En el comportamiento de cortejo de Brachyhypopomus pinnicaudatus, se observan al menos tres tipos de Chirps (Figura 3; Perrone, 2003; Silva, 2002). Estos Chirps fueron clasificados de acuerdo a su duración y estructura interna: Tipo A, son Chirps de larga duración con una desorganización tardía característica de la forma de onda con DOEs intraChirp de amplitud progresivamente creciente y decreciente que le otorga una apariencia de husos; Tipo B, son Chirps cortos con DOEs de amplitud progresivamente menor; y Tipo C, Chirps débiles caracterizados por un cambio leve de la frecuencia de descarga sin modificación notoria de la amplitud ni de la forma de onda de la DOE. Durante el comportamiento de cortejo, las hembras de Brachyhypopomus pinnicaudatus rara vez emiten Chirps, en cambio silencian su descarga frecuentemente (Figura 3). Estas interrupciones pueden ser de larga duración (varios segundos) o constituir cortos períodos de silencio intercalados entre descargas normales que llevan a la adopción de un patrón de descarga intermitente de tipo "on-off-on".
Comunicación eléctrica en el cortejo de Brachyhypopomus pinnicaudatus
Brachyhypopomus pinnicaudatus es un reproductor estacional. Aunque la conducta reproductiva de esta especie no ha sido estudiada en el hábitat natural en la región tropical, es probable que se reproduzca durante la estación lluviosa, como lo hacen la mayoría de las especies relacionadas estudiadas. En Miami, Florida, se logra la reproducción exitosa de esta especie en condiciones seminaturales por la administración de lluvia artificial que disminuye la conductividad del agua, además de asegurar la disponibilidad de sitios para la gametoposición y el aporte de alimentación abundante (Curtis y Stoddard, 2003). Recientemente, se han llevado a cabo estudios de la conducta reproductiva de Brachyhypopomus pinnicaudatus en una población de la región templada, que habita en el límite sur de la distribución continental de esta especie. En esta región, Brachyhypopomus pinnicaudatus se reproduce durante la primavera tardía y el verano (noviembreenero) asociada a una temperatura media elevada del agua y a un fotoperíodo extremo (aproximadamente 14 h luz / 10 h oscuridad; (Silva y cols., 2003).
Estas mismas claves ambientales afectan también la forma de onda de la DOE. Los machos de Brachyhypopomus pinnicaudatus presentan variaciones circadianas de la amplitud y duración de su DOE que exageran su dimorfismo sexual durante las noches de cortejo (Franchina y Stoddard, 1998). Por otra parte, la temperatura elevada del agua (alrededor de 30ºC) induce un importante decremento en la amplitud de la segunda fase de la DOE en peces de la región templada. Esta sensibilidad a la temperatura de la forma de onda de la DOE presenta variaciones estacionales y está negativamente correlacionada con la madurez gonadal (Quintana y cols., 2004; Silva y cols., 2002). Durante el período reproductivo, sólo se observan cambios mínimos de la forma de onda de la DOE dependientes de la temperatura.
A través de su acción sobre el sistema neuroendócrino, la temperatura es el estímulo ambiental más importante para el disparo del período reproductivo en Brachyhypopomus pinnicaudatus de la zona templada. La aclimatación de ejemplares adultos inmaduros a temperatura elevada y sostenida induce madurez gonadal y dimorfismo sexual morfológico y electrofisiológico (Quintana y cols., 2004). En síntesis, la temperatura ambiente es un estímulo suficiente para inducir madurez gonadal y, por lo tanto, el subsiguiente incremento de los niveles de las hormonas esteroides. A su vez, estas hormonas esteroides interactúan con la temperatura para modular la forma de onda de la DOE.
Los despliegues eléctricos y locomotores de la conducta de cortejo de una población de Brachyhypopomus pinnicaudatus oriunda de la zona templada fueron estudiados en parejas en libre movimiento, utilizando un abordaje metodológico que complementa el trabajo de campo con estudios conductuales en condiciones seminaturales en el laboratorio.
Se observaron diferencias sexuales en la emisión de señales sociales eléctricas durante el cortejo: los machos producen Chirps mientras que las hembras silencian su descarga (Figura. 3). Los Chirps e interrupciones son producidos casi exclusivamente durante la noche y es frecuente que se produzcan agrupadas en ráfagas. La Figura 4A muestra el número de señales sociales emitidas por una pareja en cortejo durante un ciclo díanoche completo. En este caso, el macho produjo 1246 Chirps en 24 h, la mayoría de los cuales se registraron en la noche (sólo 178 Chirps fueron producidos durante el día). Asimismo, los Chirps se emitieron usualmente agrupados en ráfagas de hasta 107 Chirps por minuto. La hembra interrumpió su descarga en 135 ocasiones exclusivamente durante la noche. Las interrupciones son más duraderas que los Chirps y también tienden a producirse en grupos de hasta 19 interrupciones por minuto. El valor funcional de estas señales eléctricas sociales y su rol en el cortejo se ven reforzados cuando se compara su producción a lo largo del año (Figura 4B). Durante la estación reproductiva, se registraron Chirps e interrupciones en la naturaleza y en la estación de registro conductual en el laboratorio. Durante la estación noreproductiva, se registraron algunos Chirps excepcionalmente y nunca se observaron interrupciones.

Figura 4. Variaciones diarias y estacionales en la producción de señales eléctricas sociales en parejas macho-hembra de Brachyhypopomus pinnicaudatus. A. Chirps (triángulos negros) e interrupciones (cuadrados vacíos) registradas en una pareja durante la estación reproductiva a lo largo de 24 h. La barra superior representa el ciclo luzoscuidad (13 h L - 11 h O). La gráfica representa el número de Chirps e interrupciones registradas por minuto. La gran mayoría de estas señales eléctricas sociales se producen durante la noche. B. Chirps e interrupciones registradas durante la estación reproductiva y no reproductiva. Se representan aproximadamente 6 h del ciclo diario (50 minutos antes de la puesta de sol y 300 min después). Durante la estación reproductiva, se observaron 211 Chirps emitidos por el macho y 94 interrupciones producidas por la hembra en la fase de oscuridad. En la estación no reproductiva, se observaron sólo 2 Chirps emitidos por el macho en la fase de oscuridad. (Modificado de Silva; 2002; Perrone, 2003).
La frecuencia de descarga de la DOE es mayor durante la noche cuando los peces están en su fase activa. Este aumento nocturno de la frecuencia basal fue inicialmente relacionado con el aumento de la actividad locomotora también observados durante esta fase (Black-Cleworth, 1970; Kawasaki y Heilenberg, 1989). Con el fin de separar los efectos de la temperatura y del movimiento sobre el ritmo de descarga de la DOE, se tomaron muestras de registros eléctricos a temperatura constante y sólo cuando los peces estaban inmóviles. En estas condiciones, se registró un aumento nocturno de la frecuencia basal de la DOE en ejemplares aislados y en parejas de Brachyhypopomus pinnicaudatus a lo largo del ciclo anual. Como se muestra en la Figura 5A, los valores medios de los intervalos de la DOE obtenidos de muestras de 10 s de una pareja en cortejo fueron significativamente menores durante la no che (5 h después del atardecer) que en el día (1h antes del atardecer). Esta disminución nocturna significativa de los intervalos medios de la DOE fue también observada en parejas registradas durante el período no-reproductivo (Figura 5B). A pesar de que el aumento nocturno de la frecuencia basal de la DOE se registró durante todo el año, la magnitud del mismo fue significativamente mayor durante el período reproductivo. Este aumento extraordinario de la frecuencia basal de la DOE en las noches reproductivas se ha considerado como una señal eléctrica de cortejo en sí misma. Es probable que el aumento adicional de frecuencia sea necesario como condición funcional que permita al núcleo marcapaso generar la emisión de las señales eléctricas específicas del cortejo. Los Chirps e interrupciones jamás se han observado sin que se produzca previamente ese aumento nocturno adicional de la frecuencia basal de la DOE.

Figura 5. Aumento nocturno de la frecuencia basal en Brachyhypopomus pinnicaudatus. Los datos se adquirieron de parejas macho-hembra en libre movimiento en muestras de 10 s cada 10 minutos 1 h antes y 5 h después de la puesta de sol sólo cuando los peces estaban inmóviles y la frecuencia de la DOE estable. Se representa el valor promedio del intervalo (± SD) en función del tiempo en machos (triángulos negros) y hembras (cuadrados vacíos). A. Durante el período reproductivo, todas las muestra tomadas en la noche muestran valores de intervalo menores a las obtenidas antes de la puesta de sol, indicando que la frecuencia de la DOE se incrementa durante la noche en forma independicente a la actividad locomotora de los peces. B. Durante el período no-reproductivo, también se observa una disminución nocturna del intervalo (y por lo tanto, un incremento de la frecuencia de la DOE), aunque de magnitude menor. (Modificado de Silva; 2002; Perrone, 2003).
Se ha identificado una secuencia relevante estereotipada de despliegues eléctricos y locomotores asociados en parejas cortejantes de Brachyhypopomus pinnicaudatus. Como se muestra en la Figura 6A, esta secuencia se caracteriza porque el macho se aproxima a la hembra mientras emite un Chirp, la hembra inmediatamente después interrumpe su descarga (interrupciones duraderas o intermitentes), la pareja permanece en íntimo contacto en una postura perpendicular. La ocurrencia de interrupciones de hembra siguiendo a la emisión de un Chirp de macho (en menos de 10 s) ha sido observada en varias parejas cortejantes y repetidamente a lo largo de una noche reproductiva. Con el fin de estudiar la asociación temporal entre Chirps e interrupciones, se han analizado comparativamente 45 secuencias de 24 s de duración obtenidas de 5 parejas utilizando como referencia temporal la ocurrencia del Chirp (tiempo 0). El número total de Chirps observados durante estas 45 secuencias se muestra en la Figura 6B (gráfica superior). El agudo pico observado en cero corresponde a los Chirps utilizados para alinear las secuencias, sólo unos pocos Chirps extra fueron detectados entre 12 s y + 12 s. Dado que las interrupciones son mucho más duraderas que los Chirps, sólo se consignó el comienzo de las mismas (Figura 6B, gráfica inferior). La gráfica de la suma de los inicios de las interrupciones registradas 12 s antes y 12 s después de la emisión del Chirps muestra un perfil asimétrico caracterizado por: a) la mayoría de las interrupciones fueron observadas después de la emisión del Chirp; y b) un aumento brusco (en pulso) de la producción de interrupciones se observó inmediatamente después de la ocurrencia del Chirp (dentro del primer segundo). Esta asociación temporal significativa entre la ocurrencia de las dos principales señales eléctricas involucradas en el cortejo de Brachyhypopomus pinnicaudatus sugiere fuertemente la existencia de comunicación eléctrica. Estas secuencias no son muy frecuentemente observadas durante una noche de cortejo; i.e., sólo el 10% de los Chirps emitidos por el macho son inmediatamente seguidos por una interrupción de la hembra. Aunque no frecuentes, estas secuencias, sin embargo, son probablemente importantes en la sincronización de la ovoposición por parte de la hembra y la espermiación del macho. Estas secuencias asocian despliegues locomotores estereotipados con las principales señales eléctricas de cortejo y sugieren que estos peces efectivamente dialogan y pactan la fecundación intercambiando información expresada tanto a través de despliegues locomotores como eléctricos.

Figura 6. Comunicación eléctrica durante el comportamiento de cortejo en Brachyhypopomus pinnicaudatus. A. Secuencia de despliegues locomotores y eléctricos: 1) macho (negro) y hembra (blanco) están inmóviles y separados emitiendo sus DOEs a frecuencia basal; 2) el macho se aproxima a la hembra, emite un Chirp, e inmediatamente después la hembra interrumpe su descarga por aproximadamente 400 ms; 3) ambos peces permanecen inmóviles y en posición perpendicular entre sí mientras la hembra reinstala su descarga. B. Asociación temporal de un Chirp de macho (triángulos negros) seguido por una interrupción de hembra (en menos de 10 s) (cuadrados vacíos). Datos obtenidos de 45 secuencias registradas en 5 parejas macho-hembra que exhibieron conducta de cortejo y representados usando la ocurrencia del Chirp como referencia temporal (0, panel superior). Se observa un aumento en pulso en el comienzo de las interrupciones inmediatamente después de la emisión del Chirp (panel inferior). (Modificado de Silva; 2002; Perrone, 2003).
Los Gymnotiformes son peces eléctricos americanos que usan el mismo sistema sensoriomotor para percibir el ambiente y adaptarse de modo consecuente al mismo, y para comunicarse entre coespecímenes, al objeto de establecer una organización social. Con el fin de lograr el éxito reproductivo, especialmente amenazado en animales de fecundación externa, ambos miembros de la pareja se deben comunicar para sincronizar ovoposición y espermiación. Las evidencias presentadas sobre la conducta de cortejo de Brachyhypopomus pinnicaudatus sugieren que el diálogo eléctrico es fundamental para lograr la perpetuación de esta especie.
Se pusieron de manifiesto diferencias sexuales y cambios plásticos estacionales en los núcleos responsables de la descarga en el sistema nervioso central de Brachyhypopomus pinnicaudatus. Asimismo, se observaron dos tipos de modulaciones del ritmo de la DOE en parejas de esta especie durante el cortejo: Chirps emitidos en ráfagas por los machos cortejantes e interrupciones producidas por las hembras. Estas señales se superponen a un aumento nocturno extraordinario de la frecuencia basal de la DOE que se interpreta como un requisito preliminar indispensable para la ocurrencia del cortejo eléctrico. Chirps e interrupciones son emitidos repetidamente a lo largo de las noches reproductivas en una relación temporal estereotipada entre sí y cuando ambos miembros de la pareja se encuentran en íntimo contacto, lo que refuerza el rol comunicativo de estas señales.
REFERENCIAS
Bastian, J., Schniederjan, S. & Nguyenkim, J. (2001). Arginine vasotocin modulates a sexually dimorphic communication behavior in the weakly electric fish Apteronotus leptorhynchus. Journal of Experimental Biology, 204, 1909-1923. [ Links ]
Bateson, P.P.G. & Klopfer, P.H. (1975). Perspectives in ethology. New York: Plenum Press. [ Links ]
Bennet, M.V.L., Giménez, M., Pappas, G. & Nakajima, Y. (1967). Physiology and ultrastructure of electronic junctions. IV. Medullary electromotor nuclei in gymnotid fish. Journal of Neurophysiology, 30, 236-300. [ Links ]
Bullock, T.H. (1969). Species differences in effect on electroreceptor input on electric organ pacemakers and others aspects of behavior in electric fish. Brain, Behavior and Evolution, 2, 85-118. [ Links ]
Caputti, A.A., Carlson, B. & Macadar, O. (2005). Electric organs and their control. En T.H. Bullock, C.D. Hopkins, A. Popper & R. Fay (Eds). Electroreception (pp. 410451).Springer: Handbook of Auditory Physiology. [ Links ]
ClackCleworth, P. (1970). the role of electrical discharges in the nonreproductive social behavior of Gymnotus carapo (Gymnotidae, Pises). Animal Behavior Monographs, 3, 1-77. [ Links ]
Curtis, C.C. & Stoddard, P.K. (2003). Mate preference in female electric fish, Brachyhypopomus pinnicaudatus. Animal Behavior, 66, 329-336. [ Links ]
Dunlap, K.D. & Zakon, H.H. (1998). Behavioral actions of androgens receptor expression in the electrocommunication system of an electric fish, Eigenmannia virescens. Hormones and Behavior, 34, 30-38. [ Links ]
Dye, J. & Meyer, J. (1986). Central control of the EOD in weakly electric fish. En T.H. Bullock and W. Heilengenberg (Eds). Electroreception (pp. 71102). New York: John Wiley & Sons. [ Links ]
Franchinna, C.R. & Stoddard, P.K. (2003). Plasticity of the electric organ discharge waveform of the electric fish Brachyhypopomus pinnicaudatus. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology, 183, 759-768. [ Links ]
Hagedorn, M. & Carr, C. (1985). Single electrocytes produces a sexually dimorphic signal in South American fish Hypopomus occidentales (gymnotiformes, Hypopomidae). Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology, 156, 511-523. [ Links ]
Hagedorn, M. & Heiligenberg, W. (1985). Court and Spark: electric signals in the courtship and mating pf gymnotoid fish. Animal Behavior, 33, 254-265. [ Links ]
Hagedorn, M. (1988). Ecology and behavior of a pulsetype electric fish Hypopomus occidentales (Gymnotiformes, Hypopomidae) in a fresh water stream in Panama. Copeia, 2, 324-335. [ Links ]
Hopkins C.D. (1991). Electric communication: functions in the social behavior of Eigenmannia virescens. Behavior, 50, 270-305. [ Links ]
Hopkins C.D. (1991). Hypopomus pinnicaudatus (Hypopomidae) a new species of gymnotiform fish from French Guiana. Copeia, 1, 151-161. [ Links ]
Hopkins C.D., Comfort, N.C., Bastian, J. & Bass A.H. (1990). Functional analysis of sexual dimorphism in an electric fish, Hypopomus pinnicaudatus, Order Gymnotiformes. Brain, Behavior and Evolution, 35, 350-367. [ Links ]
Kawasaki, M. & Heiligenberg, W. (1989). Distinct mechanism in a neuronal oscillator generate different signals in the electric fish Hypopomus. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology, 165, 731-741. [ Links ]
Kawasaki, M. & Heiligenberg, W. (1990). Different classes of glutamate receptors and GABA mediate distinct modulations of a neural oscillator, the medullary pacemaker of a gymnotiform electric fish. The Journal of Neuroscience, 10, 3896-3904. [ Links ]
Kirschbaum, F. (1995). Taxonomy, zoogeography and general ecology of South American knifefishes (Gymnotiformes) En P. Moller (ed). Electric fishes; history and Behavior. Fish and Fisheries Series 17 (pp. 446-464).London: Chapman & Hall, [ Links ]
Larimer, J.L. & MacDonald, J.A. (1968). Sensory feedback from electroreceptor to electromotor pacemaker centres in gymnotids. American Journal of Physiology, 214, 1253-1261. [ Links ]
Lissmann, H., Machin, K. (1958). The mechanism of object location in Gymnarcus niloticus and similar fish. Journal of Experimental Biology, 35, 451-486. [ Links ]
Lorenzo, D., Silva, A., Caputti, A.A., Borde, M. & Macadar, O. (2001). Electrogeneration in South American weakly electric fish. En B.G. Kapoor & T.J. Hara (Eds). Sensory biology of jawed fishes: New insights (pp. 121-159). Enfield: Science Publishers, Inc. [ Links ]
Manning, A. (1979). Conflict Behavior. En: E.J.W. Barrington, A.J. Willis & M.A. Sleigh, (Eds). An introduction to animal behavior (pp 161-192). London: Arnold E. Publishers Ltd. [ Links ]
Meyer, J.H. (1983). Steroid influences upon the discharge frequencies of a weakly electric fish. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology, 153, 29-37. [ Links ]
Perrone, R. (2003). Comportamiento reproductivo en Brachyhypopomus pinnicaudatus. Tesis de Maestría Inédita. Montevideo: Universidad de la República. [ Links ]
Quintana, L., Silva, A., Berois, N. & Macadar, O. (2004). Temperature induces gonadal maduration and affects electrophysiological sexual maturity indicators in Brachyhypopomus pinnicaudatus from the temperature climate. Journal of Experimental Biology, 207, 1843-1853. [ Links ]
Silva, A. (2002). Efectos de la temperatura en Gymnotiformes del clima templado. Tesis doctoral Inédita. Montevideo: Universidad de la República. [ Links ]
Silva, A., Quintana, L. Galeano, M., Errandonea, P. & Macadar, O. (1999). Water temperature sensitivity of EOD waveform in Brachyhypopomus pinnicaudatus. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology, 185, 187-197. [ Links ]
Silva, A., Quintana, L. Galeano, M., Errandonea, P. (2003). Biogeography and breeding in Gymnotiformes from Uruguay. Environmental Biology of Fishes, 66, 329-338. [ Links ]
Silva, A., Quintana, L., Ardanaz, J.L., Macadar, O. (2002). Environmental and hormonal influencies upon EOD waveform in gymnotiform pulse fish. Journal of Physiologie, 96, 473-484. [ Links ]
Spiro, J. (1997). Differential activation of glutamate receptor subtypes on a single class of cells enables a neural oscillator to produce distinct behaviors. Journal of Neurophysiology, 78, 835-847. [ Links ]
Trujillo-Cenóz, O., Echagüe, J.A. & Madacar, O. (1984). Innervation pattern and electric organ discharge in Gymnotus carapo (Teleostei, Gymnotiformes). Journal of Neurobiology, 15, 273-284. [ Links ]
Zakon, H.H., Thomas, P. & Yan, H.Y. (1991). Electric organ discharge frequency and plasma steroids levels during gonadal recrudescence in natural population of the weakly electric fish Sternopygus macrurus. Journal of Comparative Physiology. A, Sensory, Neural, and Behavioral Physiology, 169, 493-499. [ Links ]
Zupanc, G.K.H. (2002). From oscillators to modulators: behavioral and neural control of modulations of the electric organ discharge in the gymnotiform fish, Apteronotus leptorhynchus. Journal of Physiologie, 96, 459-472. [ Links ]
Recepción: Diciembre de 2005
Aceptación final: Abril de 2006
1 Correspondencia: Omar Macadar, Departamento de Neurofisiología, Instituto de Investigaciones Biológicas Clemente Estable, Avenida Italia 3318, Montevideo, Uruguay. Correo electrónico: omacadar@iibce.edu.uy.













