Serviços Personalizados
artigo
Indicadores
Compartilhar
Revista de Etologia
versão impressa ISSN 1517-2805
Rev. etol. vol.9 no.1 São Paulo jan. 2010
Artigos
Catalepsia induzida pelo lactato e atividade muscular forçada em ratos privados de sono
Catalepsy induced by lactate administration and forced muscular activity in rats
Camila Lopes da Silva; Maria Carolina Begliomini Santos; Katsumasa Hoshino
Universidade Estadual Paulista
RESUMO
O estudo comparativo das homologias comportamentais é útil para a compreensão de diferentes aspectos dos transtornos psiquiátricos. Nesta perspectiva, o presente estudo avaliou os efeitos da privação de sono REM sobre a catalepsia. Ratos privados de sono REM por 4 dias foram submetidos à administração i.p. de lactato 10mM/Kg e exercício muscular forçado, sendo, então a catalepsia avaliada. O grupo de animais privados de sono mostrou menor incidência (50%) de animais com catalepsia e média do tempo total de catalepsia menor (11,92 ± 4,12 minutos) em relação aos controles (91,7% e 26,67 ± 5,86 min respectivamente), com significâncias estatísticas no limite (p=0,05). Conclui-se que, em uma situação de perigo prolongado, a catalepsia é disparada em uma segunda instância, após o esgotamento do repertório de enfrentamentos normais da vigília, e que o sono só é compensado após o término da situação de risco.
Palavras-chave: Catalepsia. Comportamento de defesa. Sono. Ratos.
ABSTRACT
Comparative studies of behavioral homologies help understand several aspects of psychiatric disorders. The present study evaluated the effect of REM-sleep deprivation on the catalepsy induced by lactate administration plus forced muscular activity. Rats deprived of REM-sleep for 96 hs were injected i.p. with lactate solution 10mM/kg and submitted to 5 minutes of forced muscular activity. Catalepsy was then evaluated. The number of animals displaying catalepsy (50%) and mean total catalepsy time (11,92 ± 4,12 minutes) were lower in sleep deprived animals than in controls (91.7% and 26.67 ± 5.86 min respectively), results being statistically significant at the limit level (p=0,05). It is concluded that in long lasting dangerous situations, catalepsy may be triggered after normal wakefulness coping possibilities are exhausted, and sleep being manifested only when the risk situation is over.
Keywords: Catalepsy. Defensive behavior. Sleep. Rats.
Estudos comparativos entre espécies diferentes de animais são importantes para a ampliação do conhecimento e têm sido relevantes na biologia e na medicina. Embora alguns estudiosos ainda neguem a validade do estudo comparativo das manifestações de doenças mentais em outros animais, a literatura atual mostra que muitos aspectos de quadros psicopatológicos ocorrem em diversas outras espécies de maneira similar à observada em humanos. São exemplos disso os estudos sobre o desenvolvimento do quadro depressivo, com instalação de anedonia, em animais submetidos ao estresse de choques elétricos imprevisíveis e inescapáveis (Seligman & Beagley, 1975; Seligman, Rosselini, & Koza, 1975) que permitiram estabelecer a incontrolabilidade da situação aversiva como fator importante na etiologia do transtorno depressivo humano (Yadid, 2000). O quadro depressivo observado em animais é curável com os medicamentos antidepressivos usados em pacientes humanos (Wilner, 1991). Pode-se inferir que as manifestações depressivas decorrem de mecanismos homólogos, ou seja, que têm a mesma origem evolucionária. Nesta perspectiva evolutiva, uma parcela das manifestações centrais dos distúrbios mentais ou de comportamento, observadas em espécies aparentadas, pode ser considerada como expressões de desarranjos em mecanismos homólogos responsáveis pela consecução de funções adaptativas, uma vez que o processo seletivo atua sobre características vantajosas. Os estudos destas homologias são necessários para o desenvolvimento futuro da psiquiatria (Gould & Manji, 2004; Nestler et al., 2002). A etologia experimental é sem dúvida uma vertente promissora para contribuições desta natureza, tal como apontado por Tinbergen (1973) em seu discurso de recepção do premio Nobel.
As manifestações de imobilidade corporal, cujo conjunto foi denominado de suspensão comportamental (BA, Behavioral Arrest) por Klemm (2001), podem ser homologias evolucionárias de interesse neurológico e psiquiátrico por incluírem a catalepsia, que é definida como um estado de rigidez muscular aumentada e com flexibilidade de cera. Esta condição, que faz com que seu portador mantenha passivamente posturas bizarras, horas a fio, foi tida como um tipo esquizofrenia. Sabe-se entretanto hoje que ela ocorre nos transtornos de humor e se manifesta quando drogas são usadas, mesmo as medicamentosas como os neurolépticos usados no tratamento de psicoses (Fricchione, 1985; Klem, 2001; Pfuhlmann & Stober, 2001; Singerman & Raheja, 1994). A ocorrência de catalepsia acompanhada de alterações mentais é denominada de catatonia (Kaplan, Saddock, & Grebb, 1994/1997; Pommepuy & Januel, 2002). Os epsiódios de imobilidade catatônica em pacientes psiquiátricos foram observados frequentemente após crises de agitação motora que era, no passado, incluída na definição da catatonia (Dicionário de Termos Médicos de Dorland, 1999). A catalepsia observada em animais de laboratório tem sido denominada de catatonia ou catatonia experimental (Cesare, Carlini, & Carlini, 1968; Rogers & Slater, 1971). A imobilidade com perda do tono muscular é, por definição, cataplexia (Dorland, 1999) que não deve ser confundida, pela semelhança fonética, com catalepsia.
Está bem comprovado que algumas reações de BA pertecem ao repertório dos comportamentos de defesa. O congelamento comportamental (freezing), em resposta a estímulos alertantes, é defensivo por permitir que a presa passe desapercebida, ao mesmo tempo em que melhora a captação das informações sensoriais pela eliminação de interferências provenientes de outros comportamentos (Draper & Klemm, 1967; Timo-Iaria, 1985). A imobilidade tônica (hipnose animal ou tanatose) também permite ao animal defender-se em condições extremas, fingindo-se de morto para enganar o predador e possibilitar o escape do ataque iminente (Sargeant & Eberhardt, 1975, citado por Vasconcelos, 1995). A imobilidade dos filhotes de mamíferos quando supensos pela nuca para serem transportados para ninhos em lugares mais seguros (Brewster & Leon, 1980) defende-os da predação.
Esta gama de imobilidades defensivas pode ser entendida como originária de substrato neural comum, adquirido ao longo do percurso evolucionário (Klemm, 2001). As variações nas formas de indução e nas posturas adotadas nas difentes modalidades de imobilidade podem ser concebidas como incorporações evolucionárias para atender às situações específicas de cada espécie. Estas considerações levam a inferir que a catalepsia, cuja função específica não é conhecida ainda, pertença igualmente ao repertório de comportamentos defensivos, mas que seja disparado anormalmente por mecanismos ou situações especiais como as das doenças mentais, expressando-se como catatonia. Visto que os processos defensivos são adaptações para situações naturais de perigo, a procura da sua função original de defesa deve ser direcionada a condições onde as características catalépticas sejam vantajosas.
A característica mais evidente da catalepsia é a preservação da imobilidade postural, mesmo atípica, mantida tonicamente por períodos longos. A procura de situações naturais nas quais esta característica seja vantajosa para pequenos animais, como o rato, revela que uma delas é quando eles estão refugiados precariamente em galhos frágeis de árvores ou escondidos próximos aos predadores que os acuam por longo tempo, ou quando estão agarrados a algo para se manterem precariamente a salvo durante as inundações duradouras ou nas quedas acidentais na água onde a saída é difícil. A imobilidade nestas situações evita que os locais de sustentação colapsem com os movimentos e os animais caiam ou se afoguem ou, ainda, que sejam detectados pelos predadores. Esta imobilidade permite, paralelamente, uma economia da energia e retardaria a instalação da fadiga, promovida pelo ácido láctico proveniente do metabolismo anaeróbico da glicose, possibilitando maior tempo de espera para melhoria das condições. O relato popular de pessoas que foram encontradas e salvas em estado catatônico após terem caído e permanecido por dias em poços ou após desbamentos é sugestivo deste papel adaptativo.
As situações naturais onde as características da catalepsia podem ser vantajosas requerem alerta continuado e isso coloca em questão o seu relacionamento com o sono. O sono nas aves e mamíferos é constituído por dois estados principais, o sono de ondas lentas (sincronizadas) e o sono REM (paradoxal) com ondas dessincronizadas nos registros da atividade elétrica cerebral (Hoshino, 2007; Timo-Iaria, 1985). Este último ocorre ciclicamente, com relaxamento total da musculatura esquelética, movimentos oculares rápidos, manifestações oníricas e outros eventos (Jouvet, 1967). Tem possivelmente um papel funcional importante, uma vez que sua privação acarreta queda da capacidade de aprendizagem e memória, reduz a atenção, aumenta a agressividade, promove hipersexualidade, induz alucinações quando a privação é longa (Dement, 1960). Este rol de efeitos prejudiciais indica que o sono desempenha uma função importante e isto parece ser confirmado pela sua ocorrência inevitável após privação longa e pela compensação do sono perdido, em forma de rebote (Dement, 1960).
Pode-se, a partir disso, tirar algumas possibilidades: a) a privação de sono potenciaria a catalepsia prolongando o tempo de imobilidade; b) a necessidade de sono inibiria a ocorrência de catalepsia; c) a catalepsia facilitaria a ocorrência de sono; d) a catalepsia inibiria a instalação do sono.
A indução experimental de uma manifestação biológica por meios artificiais para estudá-la é potencialmente criticável se ela ocorre adaptativamente em condições naturais, tal como suposto para a catalepsia. Entretanto, a constatação recente de que a administração de lactato promove catalepsia em ratos (Cioffi-Santos & Hoshino, 2006) oferece um modelo de indução experimental de catalepsia com restrição destas críticas. O lactato é um derivado natural do metabolismo anaeróbico da glicose e se acumula nos tecidos durante o esforço muscular. A ação desta substância mostrou ser potenciada pela atividade muscular intensa dos comportamentos de esquiva emitidos quando os animais são supensos pela cauda, pelo exercício físico agudo da natação forçada, pelas intensas contrações musculares da convulsão tônica induzida pelo eletrochoque e pelas corridas incontroláveis (wild running) da crise audiogênica que dePaula e Hoshino (2002) mostraram ser fuga de pânico (dePaula & Hoshino, 2003). Esta catalepsia induzida pelo lactato mostra envolver mecanismos neurais ativos, visto que é abolido pela administração de ketamina, um anestésico de ação central e pela xilazina, um sedativo e relaxante muscular que age via receptores adrenégicos alfa periféricos e centrais.
Baseando-se nas considerações apresentadas e em função da nossa experiência com a privação de sono em animais experimentais (dePaula & Hoshino, 2002; Furlan & Hoshino, 2001; Hoshino, 1972), o presente estudo objetivou determinar os efeitos da privação prévia de sono REM por 96 horas sobre a catalepsia induzida pela associação da administração de lactato e atividade muscular forçada em ratos.
Método
Foram utilizados 24 ratos Wistar, machos, com idade de 150-160 dias de idade, provenientes do Biotério Central da Universidade Estadual Paulista, sediada em Botucatu, S.P. Os animais, depois de adaptados às condições de ciclo de luz das 7:00 às 19:00 e de escuro no restante do tempo e à temperatura de 23-24oC, foram divididos em dois grupos de 12 animais cada, sendo um deles submetido à privação de sono e o outro mantido como controle em suas gaiolas-viveiro. Os animais tiveram água potável e ração comercial ad libitum durante todo o período do estudo. Todas as manipulações experimentais obedeceram aos princípios bioéticos preconizados pelo Colégio Brasileiro de Experimentação Animal (COBEA) e aprovados previamente pela Comissão de Ética da Instituição.
A privação de sono de 96 horas de duração foi efetivada pelo método da plataforma única, idealizada por Jouvet-Monnier (1964), adaptada para ratos por Cohen e Dement (1965) e de uso freqüente em nosso laboratório (dePaula & Hoshino, 2002; Furlan & Hoshino, 2001; Hoshino, 1972, 1978). Os ratos eram colocados em uma plataforma cilíndrica de PVC de 5 cm de diâmetro e 6 cm de altura, cheia de concreto e fixada no fundo de uma gaiola de propilpropileno (25x30x16 cm), contendo água suficiente para deixar 1 cm do topo da plataforma acima da superfície. A ração comercial foi fornecida ad libitum no comedouro de barras paralelas de aço inoxidável existente na tampa da gaiola. Água potável foi fornecida de maneira constante em bebedouro convencional. A gaiola de privação foi lavada e a água em volta da plataforma trocada diariamente.
Foi utilizado o lactato de sódio provido pelo CEAQUIM, do Depto. de Química e Bioquímica do Instituto de Biociências da UNESP, Campus de Botucatu. A dose de 10 mM/Kg foi usada, usando-se solução de concentração 1 Molar.
O exercício muscular forçado foi feito suspendendo-se os ratos pela cauda para induzir movimentos de flexão abdominal para a verticalização do corpo. Na ausência de tal movimento, os animais foram sacudidos para induzí-los a apresentarem movimentos giratórios de grande velocidade. Quando paravam, eles eram colocados no teto de grades da gaiola e puxados para trás ao se agarrarem e antagonizarem seu deslocamento. Este procedimento foi repetido continuadamente, em ordem aleatória por 5 minutos.
A catalepsia foi avaliada em uma gaiola de grades metálicas tendo 30x15x15 cm de dimensão. Ela foi definida como sendo a manutenção de postura bípede sobre as patas posteriores, com apoio ou não das patas anteriores nas grades metálicas de um dos cantos do fundo da gaiola, inicialmente imposta manualmente pelo experimentador por, no máximo, 5 segundos. Seu término foi definido como sendo o momento em que o animal voltava à postura natural, com apoio de pelo menos um dos membros anteriores no assoalho da gaiola. Três avaliações foram programadas para cada intervalo de 10 minutos após o fim do exercício forçado, até completar-se 60 minutos. Os testes dos intervalos não foram realizados quando o animal mantinha a catalepsia do teste anterior. A saída dos animais da postura imposta antes dos 60 segundos iniciais não foi computada como episódios de catalepsia. O tempo total de catalepsia foi determinado pela soma dos tempos de manutenção da postura característica, medidos com uso de cronômetro manual. O tempo total de catalepsia, o número e duração dos episódios foram avaliados individualmente e anotados em formulário padronizado. Um animal controle e um privado de sono foram avaliados em todas as sessões. Os dados estão apresentados em forma de médias e respectivos erros-padrão.
O protocolo experimental seguido foi a remoção do animal da gaiola de privação ao final do tempo estipulado, sua pesagem, administração do lactato intraperitonealmente e transferência para a gaiola de avaliação da catalepsia, com monitoramento da ocorrência de sono. Vinte minutos após, os ratos foram submetidos à atividade muscular forçada por 5 minutos e devolvidos para a gaiola para avaliação da catalepsia, conforme descrito acima.
A significância das diferenças entre as taxas de incidência da catalepsia dos grupos foi avaliada através do teste de qui-quadrado e a comparação das médias dos tempos totais de catalpsia, número e tempo médio dos episódios foi feita através do teste Manova/Anova, usando-se o programa Statistica da Statsoft, tomando-se o nível de significância a probabilidade igual ou menor que 0,05.
Resultados
Todos os animais apresentaram a cabeça e o corpo secos ao final das 96 horas de privação de sono e eles continuavam sobre a plataforma, a maioria deles segurando a grade do comedouro com as patas dianteiras para manterem o equilíbrio. Todos eles tiveram episódios freqüentes de relaxamento muscular progressivo com alerta súbito quando tocavam com o focinho a água ou perdiam o equilíbrio nas horas finais do período de privação. Eventuais quedas na água eram seguidas de volta à plataforma e prolongado comportamento de limpeza corporal. Os animais mostraram não ter perdido peso corporal, apresentado ao final da privação uma média de 420 g, com variação de 370 a 503 g, que foi equivalente à média de 441 g com variação de 378 a 486 g observada nos animais do grupo controle.
Os animais apresentaram episódios breves de atividade exploratória inicial seguida de uma quietude progressiva, com vocalização intensa e tentativas de mordidas em resposta às tentativas de manipulação, quando transferidos para a gaiola de avaliação da catalepsia após a injeção do lactato. Nenhum animal apresentou sinais de dormir neste período e nos subsequentes dedicados à avaliação da catalepsia. As manifestações agressivas e vocalização se mostraram mais intensas nos animais privados de sono, fato também observado na atividade física em resposta à manipulação para indução da atividade muscular forçada.
Um total de 6 animais (50%) do grupo com privação de sono apresentou catalepsia, enquanto 11 animais (91,7%) do grupo controle manifestaram este fenômeno. Esta diferença se mostrou significante no teste de qui-quadrado (χ2=5,04; 1 g.l., p=0,0247) e uma tendência quando se introduz a correção de Yates (p=0,0724). A Figura 1 apresenta o tempo total médio de catalepsia nos animais privados de sono (11,92 ± 4,12 minutos) que mostrou ser menor que o dos controles (26,67 ± 5,86 min). A análise de variância indicou ser F=4,239, com probabilidade de ocorrência igual a 0,0509, significante, se desprezada a fração decimilesimal. O tempo médio de duração dos epísódios de catalepsia (Figura 1) nos animais privados de sono foi de 2,36 ± 0,96 min e dos animais controles de 10,23 ± 3,78 min. Esta diferença mostrou apenas uma tendência de diferença (F=3,9219, p=0,060). O número médio de episódios de catalepsia foi de 2,67 ± 0,88 nos animais privados de sono e de 3,00 ± 0,52 nos controles (F=0,106, p>0,05).
Os animais privados de sono e tratados com lactato mostraram, após finda a avaliação, intensas brigas quando transferidos para gaiolas com ratos descartados de outros estudos, indicando a cessação ou atenuação da ação cataléptica do lactato administrado.
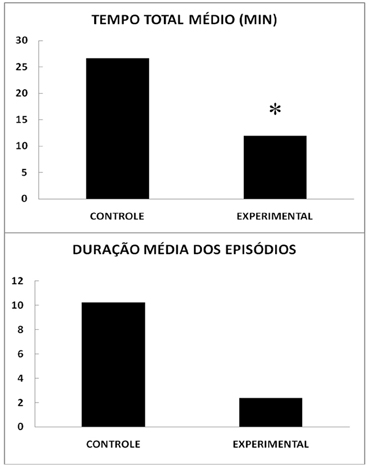
Figura 1. Catalepsia e privação de sono. Tempo total médio e duração média dos episódios de catalepsia induzida pela administração de lactato e esforço físico forçado em ratos com privação de sono REM (EXPERIMENTAL) e de seus controles com regime de sono normal (CONTROLE). Média de 12 animais por grupo. * Diferença significativa (Anova, p=0,05).
Discussão
Nossos dados mostram que um número menor de animais do grupo privado de sono apresenta catalepsia e que a média do tempo total de catalepsia neste grupo também é estatisticamente menor comparativamente ao grupo controle. Estes dados levam à interpretação de que a privação de sono possivelmente antagonize o desenvolvimento da catalepsia induzida pelo lactato associado ao exercício muscular forçado. Este antagonismo não se deve à instalação do sono compensatório que se manifesta regularmente após o fim da privação. Ao contrário, o lactato mais esforço físico parece ter contribuído sinergicamente para a preservação da vigília e motricidade. Corroboram esta interpretação o fato de a privação de sono REM promover aumento da excitabilidade cerebral (Cohen & Dement, 1965, 1970; Hoshino, 1972) que se deve, ao menos em parte, ao desenvolvimento de hipersensibilidade dos receptores dopaminérgicos D-2 (Nunes Jr., Tufik & Reis, 1994; Tufik, Lindsey, & Carlini, 1978). Esta hipersensibilidade se manifesta em forma de exacerbações comportamentais tais como aumento de atividade sexual (Andersen & Tufik, 2005; Morden, Mullens, Levine, Cohen, & Dement, 1968), agressividade (Morden, Connor, Mitchell, Dement, & Levine, 1968; Sandrin & Hoshino, 1999) ou locomoção (Albert, Cicala, & Siegel, 1970). Como o bloqueio específico destes receptores D2 por drogas, como o haloperidol, induz catalepsia (Fricchione, 1985; Klem, 2001; Singerman & Raheja, 1994; Pfuhlmann & Stober, 2001), é pertinente supor que a privação de sono, por promover a hipersensibilidade dos receptores D-2, antagoniza o desenvolvimento da catalepsia induzida pelo lactato associado à atividade muscular forçada.
A interpretação aventada para os dados do presente estudo não explica os casos de manifestação da catalepsia no grupo de animais privados de sono. Estudo recente de nosso laboratório (Cioffi-Santos, Santos, & Hoshino, em fase de redação) indica que, usando-se os procedimentos preconizados por Santos (2004) para treinar ratos a nadarem diariamente, com o fito de aumentar os seus limiares anaeróbicos (quantidade limite de exercício físico possível de ser feito sem que a taxa de lactato no sangue aumente), ocorre aumento da resistência à catalepsia. Existem diferenças interindividuais de comportamento em ratos (Carlson & Glick, 1989) e isto permite dizer que seus limiares anaeróbicos variam, sendo os de limiares maiores os resistentes à catalepsia. O único caso de ausência de catalepsia no grupo controle do presente estudo pode ser explicado também em função desta variabilidade. A ocorrência da catalepsia no restante dos animais controles confirma a alta incidência (100%) observada no estudo anterior (Cioffi-Santos & Hoshino, 2006).
O fato de a diferença entre as médias do tempo total de catalepsia ter sido considerada como significante com p=0,0509 poderia ser questionado, uma vez que envolve um milésimo a mais de probabilidade acima do nível de significância estabelecido. É preciso considerar que é praxe fazer-se a aproximação (arredondamento) em tais casos, cuja regra é para menos quando a fração for menor que 5 e, para mais, quando maior que este valor. A aceitação da diferença como significativa é coerente com a redução da incidência de catalepsia nos animais privados de sono, bem como, compatível com a tendência da duração dos episódios serem menores nos animais privados de sono. Além do mais, o fato de se aceitar como significante ou como tendência a ser significante, em nada altera a interpretação de que a privação de sono promove um antagonismo à manifestação da catalepsia.
Sanberg, Bunsey, Giordano e Normam (1988) apontam em sua revisão que existe uma variabilidade metodológica na avaliação da catalepsia em animais, inclusive, quanto ao número de testes de avaliação feitos em um mesmo animal na mesma sessão. O uso de uma única avaliação tem sido feita frequentemente na tentativa de reduzir a contaminação dos dados de catalepsia pela imobilidade decorrente da aprendizagem de esquiva, ou seja, o animal aprende a ficar na postura definida pelo experimentador porque este cessa o manuseio assim que se imobiliza, terminando uma situação aversiva de contenção e manipulação. Esta possibilidade de aprendizagem, já apontada por de Souza-Moreira, Pinheiro e Masur (1982), pode ser aventada como um ponto crítico do presente trabalho. Como se viu, a catalepsia foi avaliada a cada intervalo de 10 minutos, repetindo-se os testes por até três vezes, caso a soma dos tempos dos episódios imobilidade não completassem o intervalo. Esta interpretação não parece aceitável, primeiro, porque as nossas observações paralelas indicam que as características da imobilidade cataléptica diferem ligeiramente daquela decorrente de esquiva. Neste último caso, podem ser observados ligeiros movimentos esporádicos de cabeça e olfateios, assim como, mudanças lentas na postura que podem ser interrompidas com correções imediatas caso ocorram estímulos ambientais súbitos. Os episódios de imobilidade cataléptica são de manifestações mais estáveis e duradouras. As nossas observações indicam que a imobilidade com características de esquiva começam a se manifestar pelo 50° a 60° minuto, fato que levou limitar o tempo de observação em 60 minutos. Segundo, é preciso considerar que as diferenças foram constatadas com o uso de um só tipo de avaliação nos dois grupos e isto significa que o componente decorrente da esquiva, se existente, esteve presente nos dois grupos de modo equivalente. Por outro lado, o número médio de episódios manifestados nos dois grupos mostrou situar-se ao redor de três, um índice baixo comparado ao total máximo de 18 possíveis. Como os episódios de imobilidade cataléptica ocorreram por volta do 10° ao 40° minuto de observação, a possibilidade do componente de esquiva ter contaminado os resultados parece ser mínima. Terceiro, admitindo que a imobilidade medida no presente estudo seja composta de um componente cataléptico e outro de esquiva, a redução da imobilidade pela privação de sono através de uma ação específica sobre a esquiva não parece sustentável por ser especulativa.
A aceitação dos dados e da interpretação feita como válidos leva à consideração das questões que motivaram o presente estudo. O antagonismo da privação de sono em relação ao desenvolvimento de catalepsia sugere que a situação de perigo dispara mecanismos para a preservação da vigília ativa e que que esta tem precedência em relação à catalepsia por suscitar respostas ativas e orientadas, o que não ocorre no segundo caso, mesmo que as ondas eletrocorticais acusem a manifestação de ondas teta típicas da hipervigília, como constado por Klemm (2001). Nesta interpretação, a instalação da imobilidade cataléptica na vigência prolongada de perigo sugere ser um segundo patamar de defesa onde, após tentativas de saída da situação, a economia de energia se torna prioritária para garantir maior tempo de preservação da vida e, com isso, aumentar a probabilidade de salvamento por ocorrência de acontecimentos vantajosos para a saída da situação de risco à sobrevivência. O fato de os animais privados de sono com lactato mais atividade física não apresentarem os sinais de manifestação do sono REM (imobilidade em postura propícia ao sono, movimentos fásicos dos membros, movimentos de vibrissa, etc.) que rotineiramente aparecem (Hoshino, 1972) a partir do trigésimo minuto após o fim da privação, indica que há uma inibição do sono de compensação na vigência da catalepsia. Isso é possível, se levarmos em conta a recente demonstração de que o bloqueio dos receptores dopaminérgicos D2 reduz a compensação do sono REM (Lima et al., 2007) e que este é o mecanismo de ação do haloperidol que tem a propriedade de induzir a catalepsia, como apontado anteriormente. Estes dados sugerem que a manifestação do sono de compensação é uma prioridade de terceira ordem, expressando-se somente após a cessação do perigo.
Por fim, cabe perguntar se os dados encontrados podem contribuir para o conhecimento dos transtornos psiquiátricos. Embora precoce, os dados encontrados parecem ser concordantes com a propriedade antidepressiva da privação de sono e, como vimos, a catatonia se manifesta com alta frequência associada aos transtornos de humor.
Referências
Albert, I., Cicala, G. A., & Siegel, J. (1970). The behavioral effects of REM sleep deprivation in rats. Psychophysiology, 6, 550-560. [ Links ]
Andersen, M. L., & Tufik, S. (2005). The effects of dopaminergic agonists on genital reflexes in paradoxical sleep-deprived male rats. Physiology & Behavior, 84(2):205-10. [ Links ]
Brewster, J., & Leon, M. (1980). Facilitation of maternal transport of Norway rat pups. Journal of Comparative and Physiological Psychology, 94, 80-88. [ Links ]
Carlson, J. N., & Glick, S. D. (1989). Cerebral lateralization as a source of interindividual differences in behavior. Experientia, 45, 788-798. [ Links ]
Cesare, L. C., Carlini, G. R., & Carlini, E. A. (1967). Influence of histamine on the catatonia induced in mice by tetrabenazine and reserpine. Arch. Int Pharmacodyn. Ther., 169(1), 26-34. [ Links ]
Cioffi-Santos, J., & Hoshino, K. (2006). Exercício físico intenso e desordens de comportamento: facilitação da catalepsia/catatonia experimental pela administração de lactato. In Resumos do XXXVI Congresso Brasileiro de Psicologia [CD-ROM]. Salvador: Sociedade Brasileira de Psicologia.
Cohen, H. B., & Dement, W. (1965). Sleep: Changes in threshold to electroconvulsive shock in rats after deprivation of paradoxical phase. Science, 150, 1318-9. [ Links ]
Cohen, H.B. & Dement, W. (1970). Prolonged tonic convulsion in REM sleep deprived mice. Brain Res., 22, 421-422. [ Links ]
Dement, W. (1960). The effect of dream deprivation. Science, 131, 1705-1707. [ Links ]
dePaula, H. M. G, & Hoshino, K. (2002). Correlation between the fighting rates of REM-sleep deprived rats and susceptibility to the wild running of the audiogenic seizures. Brain Res., 926, 80-85. [ Links ]
dePaula, H. M. G., & Hoshino, K. (2003). Antipanic procedures reduce the strychnine-facilitated wild running of rats. Behav. Brain Res., 147, 157-162. [ Links ]
deSouza Moreira L. F., Pinheiro, M. C., & Masur, J. (1982). Catatonic behavior induced by haloperidol increased by retestubg abd ekucuted without drug in rats. Pharmacology, 225(1), 1-5. [ Links ]
Dorland´s illustrated medical dictionary. (1999). Philadelphia: WB Saunders. [ Links ]
Fricchione, G. L. (1985). Neuroleptic catatonia and its relationship to psychogenic catatonia. Fricchione, G. L. (1985). Neuroleptic catatonia and its relationship to psychogenic catatonia. Biol. Psychiatry, 20, 304-313. [ Links ], 304-313.
Furlan, F. A., & Hoshino, K. (2001). Fighting by sleep-deprived rats as a possible manifestation of panic: effects of sodium lactate. Braz. J. Med. Bio. Res., 34, 359-66. [ Links ]
Gould, T. D., & Manji, H. K. (2004). The molecular medicine revolution and psychiatry: bridging the gap between basic neuroscience research and clinical psychiatry. Journal Clin Psychiatry, 65, 598-604. [ Links ]
Hoshino, K. (1972). Perturbações motoras agudas induzidas pela lesão eletrolítica da formação reticular mesencefálica em ratos privados de sono paradoxal. Tese de Doutorado, Faculdade de Ciências Médicas e Biológicas, Botucatu, SP. [ Links ]
Hoshino, K. (1978). Estágios de manifestação neocortical do estado de sono dessincronizado. Tese de Livre-Docência, Universidade Estadual Paulista, Botucatu, SP. [ Links ]
Hoshino, K. (2007). Aspectos filogenéticos do sono. In S. Tufik (Org.), Medicina e biologia do sono. São Paulo: Manole. Cap. 2. [ Links ]
Jouvet-Mounier, D., Vimont-Vicary, P., Delorme, F., & Jouvet, M. (1964). Étude de la privation selective de la phase pradoxale du sommeil chez le chat. C. R. Soc. Biol., 158, 756-759. [ Links ]
Jouvet, M. (1967). Neurophysiology of the states of sleep. Physiol. Review, 47, 117-177. [ Links ]
Kaplan, H. I., Sadock, B. J., & Grebb, J. A. (1994/1997). Compêndio de psiquiatria (7a ed.). Porto Alegre: Artmed. [ Links ]
Klemm, W. R. (2001). Behavioral arrest: In search of the neural control system. Progress in Neurobiology, 65, 453-471. [ Links ]
Lima, M. M., Andersen, M. L.; Reksidler, A. B., Silva, A., Zager, A., Zanata, S. M., Vital, M. A., & Tufik, S. (2007). Blockade of dopaminergic (D2) receptors produces decrease of REM but not of slow wave sleep in rats after REM-sleep deprivation. Behav. Brain Res. (In press) [ Links ]
Morden, B., Connor, R., Mitchell, G., Dement, W., & Levine, S. (1968). Effects of rapid eye movement (REM) sleep deprivation on shock-induced fighting. Physiol. Behav., 3, 425. [ Links ]
Morden, B., Mullens, R., Levine, S., Cohen, H., & Dement, W. (1968). Effect of REN sleep deprivation on the mating behavior of male rats. Psychophysiology, 5, 241. [ Links ]
Nestler, E. J., Gould, E., Manji, H., Buncan, M., Duman, R. S., Greschnfeld, H. K, Hen, R. et al. (2002). Preclinical models: Status of basic research in depression. Biological Psychiatry, 52, 503-528. [ Links ]
Nunes Jr., G.P.; Tufik, S. & Nobrega, J.N (1994). Autoradiographic analyssis of D1 and D2 dopaminergic receptors in rat brain after paradoxical sleep deprivation. Brain Res. Bull., 34(5), 453-456. [ Links ]
Pfuhlmann, B., & Stober, G. (2001). The different conceptions of catatonia: historical overview and critical discussion. Eur. Arch. Psychiatry Clin. Neurosci., 251(Supl.1), 14-17. [ Links ]
Pommepuy, N., & Januel, D. [Catatonia: Resugence of a concept. A review of the international literature]. Encephale, 28, 481-492.
Rogers, K. J., & Slater, P. (1971). Brain acetylcholine and monoamines during experimental catatonia. J. Pharm. Pharmacol., 22(2), 135-137. [ Links ]
Santos, J. W. (2004). Treinamento: periodização aeróbio. Tese de Doutorado, Universidade Estadual Paulista, Rio Claro, SP. [ Links ]
Sandberg, P. R., Bunsey, M. D., Giordano, M., & Norman, A. B. (1988). The catalepsy test: its ups and downs. Behav. Neurosci., 102, 748-759. [ Links ]
Sandrin, M. F. N., & Hoshino, K. (1999). Agressividade de ratos privados de sono: caracterização etológica dos confrontos agonísticos como padrões de comportamento defensivo. Revista de Etologia, 1, 9-18. [ Links ]
Seligman, M. E. P., & Beagley, G. (1975). Learned helplessness in the rat. Journal of Comparative and Physiological Psychology, 88, 534-541. [ Links ]
Seligman, M. E. P., Rosellini, R. A., & Kozak, M. J. (1975). Learned helplessness in the rat: time course, immunization, and reveesibility. Journal of Comparative and Physiological Psychology, 88, 542-547. [ Links ]
Singerman, B., & Raheja, R. (1994). Malignant catatonia – a continuing reality. Ann. Clin. Psychiatry, 6, 259-266. [ Links ]
Timo-Iaria, C. (1985). Neurofisiologa. In M. M. Aires, Fisiologia básica. Rio de Janeiro: Guanabara Koogan. [ Links ]
Tinbergen, N. (1973). Ethology and stress diseases. Nobel Lecture, December 12, 1973. Disponível em: http://nobelprize.org/nobel_prizes/medicine/laureates/1973/tinbergen-lecture.pdf [ Links ]
Tufik, S., Lindsey, C. J., & Carlini, E. A. (1978) Does REM-sleep deprivation induce a supersensitivity of dopaminergic receptors in the rat brain? Pharmacology, 16(2), 98-105. [ Links ]
Vasconcelos, C.R.F. (1995). Mesencéfalo basal de sapos e comportamento defensivo: sistema gabaérgico e opióide. Dissertação de Mestrado, Universidade de São Paulo, Ribeirão Preto, SP. [ Links ]
Wilner, P. (1991). Behavioural models in pssychopharmacology: Theoretical, industrial and clinical persepectives. Cambridge: Cambridge University Press. [ Links ]
Yadid, G. (2000). Elucidation of neurobiology of depression: Insights from a novel genetic animal model. Neurobiology, 62, 353-378. [ Links ]
Recebido em: 21/03/2008
Aceito em: 20/09/2009
K. Hoshino, Depto. C. Biológicas – Faculdade de Ciências, Universidade Estadual Paulista – UNESP. Av. Luiz Edmundo Carrijo Coube, 14-01, 17033-360 - BAURU – S.P. Fone 55-014-3103-6092. E-mail: hoshino@fc.unesp.br














